Fiche 110 b Le complexe moucheture et tache de suie
Fiche 110b
Vincent Philion
La moucheture (en anglais, « flyspeck ») et la tache de suie (en anglais, « sooty blotch ») sont causées par plusieurs espèces de champignons qui laissent à la surface des pommes, des poires et de nombreux autres fruits des taches superficielles affectant surtout leur apparence1 et donc leur valeur économique. Dans l’est des États-Unis, des pertes pouvant atteindre 90 % sont rapportées2. En entrepôt, la maladie accélère également la perte en eau1,3, ce qui cause des pertes additionnelles en volume. Les deux maladies sont considérées ici conjointement sous le nom « complexe suie-moucheture », en lien avec l’acronyme anglais « SBFS » (sooty blotch, flyspeck). Dans certaines régions, on parle également de « sooty mold4,5 » qui est la même chose.
La suie-moucheture est présente mondialement et est rapportée dans la littérature de différents pays sur poires et sur pommes depuis au moins 18326, mais aussi sur d’autres fruits1. Elle cause des pertes économiques dans plusieurs régions des États-Unis, du Canada, en Europe2,7, soit dans toutes les régions pomicoles du monde où on trouve des conditions humides pendant le développement des fruits en été. Dans l’Est des États-Unis, jusqu’à la moitié des traitements fongicides (4 à 8 applications) sont dirigées contre cette maladie8. Au Québec, la SBFS reste d’importance secondaire, mais cette maladie est de plus en plus fréquente dans les vergers.
Partout où la maladie est présente, le scénario est le même : les spores produites sur les plantes porteuses sont éclaboussées sur les fruits pendant les pluies et les champignons colonisent superficiellement la couche cireuse des pommes. Les infections sont possibles pendant toute la période où les fruits sont présents dans l’arbre. Dans les vergers où la suie-moucheture apparait, les symptômes ont tendance à s’accroitre au cours des années7,9,10 à moins que des actions soient prises pour casser le cycle de la maladie.
L’apparition des symptômes est tributaire de la présence des hôtes qui maintiennent un réservoir pour les contaminations, de conditions météorologiques humides durant l’été qui permettent le développement de la maladie et des interventions pour la contrer.
Étiologie (cause)
Historiquement, la moucheture (Schizothyrium pomi ou sa forme imparfaite Zygophiala jamaicensis) et la suie (Gloeodes pomigena) étaient chacune associées à un champignon, même si les premières études sur ces maladies relataient déjà la possibilité que les symptômes étaient l’expression de plusieurs champignons responsables d’une seule et même maladie6. Des travaux entrepris au cours des vingt-cinq dernières années11 ont confirmé cette hypothèse et démontré que le nombre d’espèces impliquées dans le SBFS est souvent très élevé. En fait, cette maladie est maintenant considérée comme la plus compliquée du point de vue de la diversité des organismes responsables12. Selon les localités, le complexe suie-moucheture est associé à un assortiment parmi un total de plus de 100 espèces12,13 de champignons très diversifiés1,14, dont plusieurs ont été reclassées au cours des années12. Un bon nombre d’espèces sont dans l’ordre des Capnodiales (classe Dothideomycetes)1. Les Capnodiales sont aussi connus pour leur implication dans la fumagine, qui pousse sur le miellat des insectes7. Au moins 30 des espèces sont présentes aux USA. Sept espèces du genre Zygophiala et Schizothyrium pomi sont à l’origine des mouchetures « classiques »15, alors que le spectre des espèces responsables des variantes de la suie est plus vaste. Les genres les plus fréquents des suies étant Peltaster sp. et Geastrumia dans le Nord-Est des USA16. Il est très difficile d’extrapoler d’une région à l’autre puisque les espèces présentes varient sur d’assez courtes distances17 et sont très adaptées au climat local. De plus, les espèces identifiées dans chaque région varient selon les vergers. Par exemple, on peut trouver de 2 à 15 espèces différentes par verger14 qui varient selon les stratégies fongicides17,12. Une plus grande diversité d’espèces et une plus grande sévérité de la maladie sont présentes dans les vergers non traités aux fongicides1. Cependant, la sévérité de la maladie n’est pas toujours un bon indice de la diversité des champignons présents13. Le nombre d’espèces trouvés est en lien le nombre d’heures de mouillure pendant la saison13.
Symptômes de la maladie
Dans la littérature classique6 on réfère à deux types de symptômes :
La suie tire son nom de l’apparence des symptômes, soit une tache souvent fuligineuse (sombre) de couleur brun noirâtre, sans contour défini. Cette tache est une couche enchevêtrée et dense de ramifications appelé mycélium qui forme un thalle foncé aux pourtours indéfinis. Dans ce thalle, différents types de fructifications peuvent apparaître selon l’espèce. La suie se décline en au moins 3 types selon les espèces impliquées : ramose (ramifiée, ex. : Geastrumia sp.), ponctuée (ex. : Peltaster sp.), ou fuligineux (ex. : Leptodontium sp.)2.
La moucheture a l’apparence d’excréments de mouche. Les taches sont composées d’une multitude de petits points noirs groupés, sans qu’il y ait de trace de lésion sur l’épiderme du fruit. Les bordures des points noirs (thyriothécies) sont très définies et forment les petites taches circulaires caractéristiques. Les taches sont néanmoins reliées entre elles par un réseau mycélien invisible à l’œil nu18.
Entre les deux grands types de symptômes, plusieurs variantes existent18 et d’autres classifications ont été proposées1. Selon l’endroit, les symptômes de SBFS forment un continuum impossible à classer et la distinction suie vs moucheture n’est plus faite1,14. L’identification des espèces impliquées doit donc nécessairement reposer sur des critères génétiques et non sur l’apparence des symptômes.
Les symptômes de la suie-moucheture se développent dans des conditions similaires pour la plupart des espèces impliquées aux USA et une gamme variée de symptômes apparait souvent simultanément à la surface des fruits à l’approche de la récolte.
Épidémiologie
Chaque espèce impliquée dans le complexe SBFS a des particularités propres qui rendent complexe une étude détaillée. Ainsi, la température optimale de croissance, la sporulation, la sensibilité aux fongicides et d’autres traits sont variables d’une espèce à l’autre. Cependant, certaines propriétés sont assez communes pour brosser un portrait global du fonctionnement de la maladie.
Hiver
Les champignons du SBFS passent l’hiver sur de nombreux hôtes réservoirs comme les ronces (framboises, mûres), plusieurs espèces forestières18 dont le cornouiller (cornus), l’aubépine, mais aussi le chêne, l’érable, le saule et peut-être même certains crucifères comme la moutarde noire6 (Brassica nigra) et des plantes ornementales comme l’oeillet19 (Dianthus caryophyllus). En fait, la gamme d’hôtes est probablement très vaste2, même si elle est assez spécifique aux espèces présentes12. Les plantes qui arborent ces champignons peuvent être présentes dans les forêts environnantes ou dans les vergers. La moucheture et la suie peuvent également passer l’hiver sur les pommes laissées au sol2, sur les momies dans les arbres1 et sur l’écorce des pommiers2.
Arrivée des spores
Le cycle d’une bonne part des mouchetures est mieux connu que celui des suies. Un peu comme pour la tavelure, les thyriothécies produites par la moucheture libèrent au printemps des ascospores qui causent les premières infections. Les conidies prennent la relève pour toutes les infections subséquentes20. La suie pour sa part toujours causée par des conidies qui sont éclaboussées à partir des plantes hôtes. L’arrivée des premières spores a lieu environ au stade de la floraison du pommier et peut continuer en été pour la moucheture21 et jusqu’en septembre dans le cas de la suie18. À l’exception des vergers très atteints, les premières spores (inoculum primaire) arrivent de l’extérieur du verger et ne sont pas très nombreuses. Ces spores atterrissent à la fois sur les pommiers et sur les hôtes environnants. Très souvent les traitements dirigés contre les ascospores de la tavelure empêchent l’infection primaire de suie-moucheture sur pommiers. Sur les plantes non protégées environnantes, les spores ont besoin d’une longue période d’humectation pour compléter leur cycle d’infection et pour produire de nombreuses spores (conidies) qui seront ensuite responsables de la plupart des infections sur fruits en verger. Le vent et la pluie libèrent les spores qui sont ensuite éclaboussées sur les pommes.
Infection
Les spores qui atterrissent sur les pommes ont probablement besoin d’eau libre pour germer ou pour croitre13, mais ont certainement besoin de conditions très humides pour s’implanter. La germination et la croissance sont aussi favorisées par une température élevée. La progression de la maladie est brutalement interrompue par les périodes sèches. Aucune croissance n’a lieu quand l’humidité est inférieure à 90 % pour la suie22 et 96 % pour la moucheture20. La suie serait donc moins sensible à des périodes plus sèches que la moucheture20,22.
Pour la température, la croissance est possible dans une gamme assez large et variable selon les champignons impliqués. L’optimum pour la moucheture serait vers 20 °C, avec un minimum à 12 °C et un maximum vers 30 °C. Pour la suie, l’optimum de Peltaster sp. serait autour de 12-24 °C avec un minimum à 8 °C et un maximum à 28 °C22 alors que pour Leptodontium sp., l’optimum peut atteindre 32 °C selon l’humidité, avec un maximum à 36 °C22. Certaines espèces présentes dans le Nord-Est de l’Amérique (Dissoconium sp.) croissent bien au froid jusqu’à 10 °C23. Des périodes d’humidité plus longues sont requises pour la germination à mesure que la température s’éloigne de l’optimum20.
En dehors de la plage d’humidité et de température, la croissance s’arrête mais les champignons du SBFS peuvent néanmoins survivre de longues périodes aux périodes sèches16. La croissance reprend dès que les conditions à la surface des fruits sont favorables. Les nouvelles infections peuvent avoir lieu tout au long de l’été18,24,25, mais la majorité des contaminations ont lieu dans la première moitié de la période de développement du fruit26, même si l’apparition des symptômes a lieu beaucoup plus tard.
Mode de vie
Les champignons de la suie-moucheture sont donc considérés des « épiphytes », soit des organismes qui vivent à la surface des plantes. Contrairement à d’autres maladies fongiques, pratiquement aucune pénétration de la cuticule n’a lieu6. Certaines espèces traversent éventuellement la cuticule18,27, mais ne vont pas plus loin. On parle alors de champignons « ectophytes », qui restent néanmoins très superficiels et qui n’éveillent peut-être même pas les mécanismes de défense de la plante12. Comme la plante n’est jamais « atteinte », certains auteurs hésitent même à parler d’une « maladie »7. Comme ils restent à la surface, les suies et les mouchetures ne sont pas protégés par la plante et sont dotés de mécanismes particuliers pour survivre aux températures élevées, aux conditions sèches, aux rayons UV et à la compétition avec d’autres organismes pendant la saison. Ils sont donc très résilients.
Dans les premières phases de développement des fruits, la cuticule n’est pas un milieu très riche en nutriments pour les champignons. Plus tard en saison, les fruits suintent les sucres et les acides organiques utilisés pour leur croissance28. Une partie de ce suintement a lieu en lien avec les microfissures présentes à la surface des fruits29. Toutes les espèces profitent des exsudats libérés par la pomme7,30, ou des exsudats parfois éclaboussés des feuilles environnantes. Les champignons responsables de la moucheture19 et certaines suies7 peuvent aussi se nourrir de la cire des pommes. Malgré les ressources limitées, les spores peuvent s’installer sur les fruits dès la nouaison, mais il est possible que les infections avant la fin de la division cellulaire (stage-T, BBCH74) soient moins nombreuses, quoique ce stade minimal avant l’infection ne fait pas l’unanimité7.
Apparition des symptômes
Entre l’arrivée des spores et l’apparition des symptômes, les champignons colonisent discrètement la surface du fruit et rien n’est visible à l’œil nu. L’apparition des symptômes est liée à une maturation des colonies qui sont d’abord transparentes et qui noircissent. C’est la production de mélanine, un pigment foncé, qui permet de voir les colonies. La mélanine aide aux colonies à mieux tolérer l’environnement hostile à la surface des fruits. Comme la production de mélanine est plus prononcée en présence de sucres, elle augmente à mesure que la saison progresse. Le noircissement parfois soudain à l’approche de la récolte est donc en partie liée à la production des exsudats sucrés à la surface des fruits qui accélèrent (pour certaines espèces23) la « maturation » des colonies de SBFS16 déjà en place.
Les symptômes de SBFS apparaissent normalement entre 3 semaines ou un mois après l’infection, mais peuvent être visibles après seulement 8 jours quand les conditions sont optimales (très humides). À l’inverse, l’apparition des symptômes est retardée indéfiniment quand le temps est sec. Quand la croissance cumulée atteint un seuil minimal d’heures de mouillure, les colonies commencent à être visibles. L’apparition des symptômes est graduelle après le seuil minimal d’environ 200 h et certaines colonies implantées ne deviennent visibles que beaucoup plus tard. Il peut s’écouler plusieurs mois après l’arrivée des spores pour cumuler assez d’heures favorables à la croissance et atteindre le moment où toutes les colonies deviennent entièrement visibles. Selon les localités et les conditions météorologiques, les premiers symptômes peuvent apparaitre dès la fin juin31, mais tous les fruits peuvent aussi virer noirs dès la fin juillet. Le plus souvent, la maladie est observée à la récolte suite à des pluies à la fin de l’été6.
Propagation à partir des pommes
La plupart des champignons impliqués dans la suie-moucheture en Iowa sont monocycliques, c’est-à-dire qu’il n’y a pas de propagation en saison après l’infection de la pomme (ex. : la moucheture classique Schizothyrium). La sporulation et la propagation est possible à partir des plantes hôtes, mais il n’y a pas de sporulation à partir des taches sur les fruits en verger12,13,26. Cependant, certaines espèces responsables de la moucheture2,32 peuvent sporuler (conidies) sur les pommes et la suie commune (Peltaster sp.) produit de grandes quantités de « blastospores » à la surface des fruits qui permettent une propagation (polycylique)26. Comme pour la croissance du champignon, cette production de spores est aussi favorisée par les périodes d’humectation12. Lorsque la suie est présente, la propagation de la maladie est fortement liée aux épisodes de pluie, et moins à la durée d’humectation33. Selon les espèces présentes, la propagation entre fruits est donc possible en saison au gré des périodes de pluie qui permettent le déplacement des spores.
Récolte
Les pluies jusqu’à la récolte peuvent entrainer l’arrivée de spores et provoquer de nouvelles infections. Les symptômes à la suite des infections peuvent être aggravés à chaque période de mouillure des fruits avant ou après récolte. Cependant, comme le temps de mouillure requis pour que les symptômes apparaissent est très long, les infections dans les semaines qui précèdent la cueillette des fruits ne causent pas de problèmes. Si les fruits demeurent secs après la récolte, les symptômes déjà présents ne seront pas aggravés.
Entreposage
À moins que les fruits soient mouillés par trempage avant l’entreposage, la propagation entre fruits est peu probable. Les spores (ex. : suie) à la surface des fruits ne sont pas transportées par les courants aériens. La propagation est cependant possible si les fruits séjournent dans l’eau contaminée par d’autres fruits. Cependant, comme la période d’incubation est très longue, l’apparition de symptômes suite à une contamination post récolte est très peu probable. Par contre les symptômes en lien avec les infections avant la récolte peuvent continuer leur apparition2,13,34 sur les fruits en entrepôt, notamment dans les régions où les espèces tolérantes au froid sont présentes (ex. : Dissoconium sp.). La sortie des symptômes est également possible en atmosphère controllée5 (AC). L’apparition en entrepôt est directement liée à l’humidité de la chambre. Dans les chambres moins humides, les symptômes ne se développent pas (Trapman, comm. pers). L’apparition des symptômes en entrepôt AC est probablement aggravée par l’humidité ambiante plus élevée de ce type de chambre. Quand les symptômes sont déjà visibles, le bris de la cuticule causé par les champignons provoque une perte d’eau et de volume accélérée18 tout au long de l’entreposage, peu importe le type de chambre.
Modèles de prévision
Au moins deux approches de modélisation sont utilisées pour prédire la suie-moucheture et aider à mieux cibler les traitements. Le plus connu est le modèle empirique américain Brown–Sutton–Hartman (BSH) et ses différentes déclinaisons régionales. En production biologique, un modèle européen pour la suie est disponible pour les utilisateurs de RIMpro35. Les deux modèles ne sont pas parfaits et peuvent rater des infections (faux négatifs)36,37, mais sont néanmoins souvent jugés utiles pour économiser des traitements sans trop augmenter le risque. Même si les champignons responsables de la SBFS partagent des traits communs, il est possible que l’assemblage local des espèces présentes réagisse un peu différemment à la température et l’humidité et donc que les modèles développés à l’étranger ne soit pas optimaux localement37.
BSH
Le modèle (et ses déclinaisons) cumule le temps de mouillure qui mène à la première apparition de symptômes, sans égard à la biologie des champignons en cause. Par la suite, les infections sont considérées « en continu » au gré des heures de mouillure jusqu’à la récolte38. La plupart des variations entre les déclinaisons régionales reposent sur des équipements de mesure et des seuils différents. Le point de départ des calculs (biofix) est aussi variable, par exemple après la chute des pétales ou après le lessivage des traitements contre la tavelure. Le premier traitement est retardé sur la base de seuils, mais les traitements suivants sont habituellement faits selon une stratégie « calendrier » à intervalles réguliers jusqu’à la récolte en diminuant la fréquence lors d’été secs, mais sans critère précis39.
Comme les heures d’humectation peuvent être calculées de plusieurs façons (ex. : toutes les heures, ou périodes plus longues seulement) et avec différents instruments40 et que les seuils sont différent selon les modèles et les régions, les résultats sont très variables8 et la « version » du modèle optimale varie selon les régions37.
La première version développée en Caroline du Nord40 suggérait de débuter les traitements avant l’apparition des symptômes qui étaient prédits après 273 h de mouillure (HM) en cumulant les humectations de plus de 4 h enregistrées sur un fil de crin (DeWit) à partir de 10 jours suivant la chute des pétales. Les auteurs considéraient que le seuil était valable pour débuter les traitements dans les vergers très atteints, mais qu’il devrait être adapté selon l’environnement du verger39.
Dans l’état de New York34, la proposition de Rosenberger est de compter toutes les heures d’humectation en débutant plus tôt (chute des pétales) avec un seuil à 270 HM. Cependant, le système Rosenberger considère les fruits protégés par les infections contre la tavelure jusqu’au premier seuil et l’apparition des symptômes est donc prédite après l’infection des pommes et le cumul d’une autre période d’incubation de 270 HM, soit un total de 540 h de mouillure après la chute des pétales. Le premier traitement est recommandé au seuil de 270 h de mouillure après chute des pétales (175 h avec un capteur électronique), et ne pas laisser plus de 270 HM sans couverture fongicide jusqu’à récolte34. Le dernier traitement serait recommandé dans les vergers avec une forte pression si le dernier traitement fongicide est lessivé (50 mm) et que la récolte est prévue un mois plus tard (ou plus)34.
RIMPro
Ce modèle vise à simuler le cycle de la suie commune (Peltaster). La suie a été choisie parce qu’elle est universelle, qu’elle survit mieux aux conditions sèches que la moucheture et qu’elle peut réinfecter à partir des fruits en cours d’été. Contrairement au système BSH, le modèle RIMpro repose sur l’hypothèse que la plupart des infections sur fruits résultent des spores éclaboussées par la pluie et que les infections ne sont donc pas en continu.
À partir du seuil de 20 jours après la pleine floraison, le modèle considère que les fruits deviennent sensibles et simule l’arrivée des spores par éclaboussement par la pluie. Le modèle prévoit un accroissement des sources de spores à mesure que la saison progresse. Un processus d’infection modulée selon la température est calculé tant que la mouillure est présente. Pendant les périodes sèches, une courbe de mortalité des spores non infectées est intégrée au modèle. Pour chaque arrivée de spores et d’une nouvelle infection, les premiers symptômes sont prédits en moyenne après accumulation de 300 heures de mouillure et tous les symptômes sont considérés visibles après 500 heures de mouillure. La stratégie proposée est d’appliquer un traitement (bicarbonate, bouillie soufrée, cuivre) dans les 20 heures suivant le début d’une infection grave selon le graphique. Cette approche réduit le nombre de traitements requis en régie bio (environ 3 par été), en comparaison aux traitements à chaque 100 ou 150 heures de mouillure normalement requis pour les fongicides qui n’ont pas d’effet en post infection.
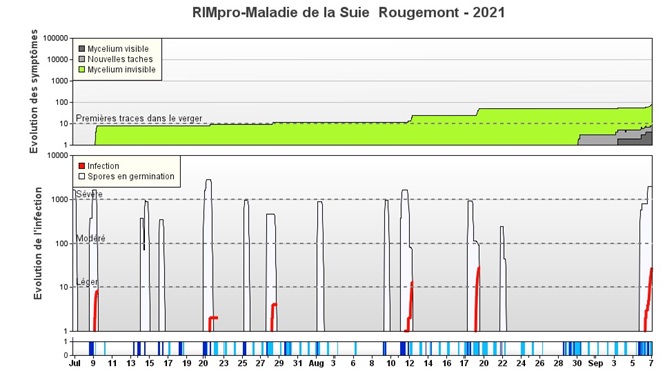
Figure 2. Début d’une saison de suie-moucheture selon RIMpro. La pluie du 9 juillet provoque une infection (ligne rouge) et de nouvelles spores (zone verte) débutent la colonisation des pommes. Les colonies de cette première infection commencent à devenir visibles (zone grise), vers le 28 août. Les symptômes de cette infection deviennent entièrement visibles vers le 7 septembre, au moment où la zone grise atteint le même niveau que l’infection initiale, soit deux mois plus tard.
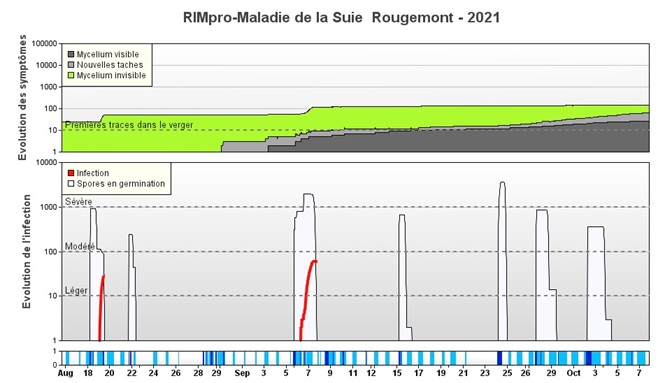
Figure 3. Infections de suie-moucheture avant récolte selon RIMpro. Les pluies entre le 28 et le 30 août (moins de 5 mm au total) ne sont pas considérées comme une infection parce que la dispersion des spores par la pluie est jugée minimale. Par contre, les pluies importantes du 18 août et du 5 septembre génèrent les dernières infections (lignes rouges) de la saison. Le seuil des symptômes potentiels (zone verte) observé avant l’infection du 18 août (environ 50 sur l’échelle de l’évolution des symptômes) se traduit par des symptômes visibles vers la fin septembre (la zone grise monte à 50). L’infection du 18 août (et les suivantes) qui fait monter l’indice proche de 100 ne contribue pas à des symptômes visibles si les pommes sont récoltées avant octobre.
Avant de se mouiller : Tous les modèles utilisés pour prédire l’apparition des symptômes de suie-moucheture partagent une limite : les stations météos automatiques ne sont pas conçues pour enregistrer les périodes de mouillure sur fruits et la variation observée selon l’équipement et le type de mesure à l’échelle du pommier, du verger et des régions est immense. Par exemple, le modèle BSH développé avec une sonde « deWit »40 manuelle est incompatible avec les stations météos électroniques. En utilisant les mêmes critères mais des appareils différents, la validation de BSH au Massachussetts a révélé un écart important (236 à 586 heures d’humectation de plus de 4 h) avant l’apparition des premiers symptômes (24 juillet au 17 août)41. De même, le système « Skybit » utilisé sans calibration enregistrait plus d’heures de mouillure que les sondes, ce qui engendrait en moyenne plus de traitements que nécessaire36.
La rosée (qui contribue à l’infection de suie-moucheture) est complexe à quantifier et contribue à des périodes d’humectation beaucoup plus variables que la pluie37. Par exemple, le nombre d’heures de mouillure entre la base des arbres et le haut des arbres est en moyenne plusieurs heures plus faible42. Il s’en suit qu’une différence de positionnement de capteur de 50 cm peut faire changer la recommandation de traitement de 7 jours42. La durée de mouillure des fruits est aussi plus longue dans la zone du pédoncule qui forme une cavité que sur les côtés des fruits35.
Comme l’estimation des heures de mouillure n’est pas facile, la version « Gleason-Duttweiler » (Iowa) du modèle BSH recommandait plutôt un seuil de 192 h avec une humidité relative de l’air ≥ 97 %37 pour des périodes de 4 h ou plus. Ce système a depuis été simplifié43 et recommande maintenant de cumuler toutes les heures où l’humidité de l’air est > 90 %, avec un seuil de 385 h pour le premier traitement. Dans RIMpro, le déficit de pression de vapeur (VPD) est utilisé comme critère d’humectation. Le cumul des heures avec un VPD inférieur à 2 serait préférable pour établir un seuil parce que moins sujet aux variations observées avec l’humidité relative ou les sondes (Trapman, comm. pers.).
Dépistage préventif de pommes sentinelles
Comme les modèles ne tiennent pas compte de l’historique de la parcelle, les traitements recommandés par ceux-ci ne sont pas toujours nécessaires (faux positifs). Dans les parcelles sans source de spores (inoculum), les conditions météorologiques favorables à la maladie ne risquent pas de provoquer l’apparition soudaine de symptômes. Cependant, comme les abords des vergers peuvent changer et que des plantes hôtes peuvent s’installer, il est peut-être utile de considérer le dépistage préventif pour éviter les surprises à la récolte. L’échantillonnage aléatoire à intervalle régulier (ex. : chaque deux semaines) à partir de la nouaison d’un lot aléatoire de 50 pommes par bloc est suffisant pour déterminer si des symptômes vont apparaitre plus tard en saison. Il suffit de conserver ces pommes à la température ambiante, mais dans des conditions humides44–46 (ex. : sacs de plastique). Sur les fruits infectés récemment, les symptômes sur les pommes ensachées apparaissent après environ 10-14 jours d’incubation au maximum et sont facilement visibles bien avant ceux de la récolte. Si les traitements sont débutés dès l’apparition des symptômes sur ces pommes « sentinelles » (et donc avant les symptômes en verger), il est possible de se prémunir des nouvelles infections en cours d’été et d’amoindrir les dommages à la récolte.
Gestion de la maladie : prévention
Site, aménagement et assainissement
Le choix du site pour l’implantation d’un verger peut expliquer en partie la sévérité des problèmes observés. La suie-moucheture est aggravée dans les vergers à proximité de forêts où les hôtes alternes sont abondants et dans les sites où le drainage de l’air est inadéquat18,39. Dans les vergers implantés, maintenir le couvert végétal bas (fauchage, herbicide) peut aider à réduire l’humidité dans les vergers et ainsi limiter l’infection des fruits les plus bas47, cette intervention peut aussi aider à limiter la sporulation sur les hôtes réservoirs (ex. : ronces) présentes dans le verger. Cependant, à moins que l’herbe soit haute au point de modifier le climat du verger, une gestion plus intensive de la végétation au sol ne changera pas grand-chose à la sévérité de la maladie4. L’élimination des ronces (framboises, mûres, etc.) autour des vergers ou des fruits momifiés accrochés aux arbres7,12,38,48 sont aussi des solutions partielles pour réduire le problème à la source. Malheureusement, les machines dédiées à l’éclaircissage (ex. : Darwin) ne réussissent pas bien à enlever les momies en hiver7.
Cultivars
La plupart des cultivars sont sensibles à la maladie à des degrés divers et la résistance n’est pas une stratégie porteuse pour réprimer la suie-moucheture49. Les cultivars tardifs sont plus souvent atteints parce que la maladie a plus de temps pour se multiplier49 et les traitements fongicides sont souvent interrompus à l’échelle de la ferme et non en fonction de la date de récolte des cultivars. Les cultivars rousselés (ex. : Russet) ou les surfaces rousselées des autres fruits seraient naturellement résistants7,30. Les cultivars aux couleurs pâles accentuent l’apparence des symptômes49, même si la sensibilité n’est pas associée à la couleur du fruit49. Certaines exceptions à ces règles existent. Par exemple, la Ginger Gold est significativement plus sensible que les autres cultivars qui murissent à pareille date alors que c’est l’inverse pour Pinova49. Ces différences sont probablement dues à la quantité d’exsudats produite par ces fruits. Finalement, les cultivars plus sujets à la formation de fruits momifiés (ex. : Cortland), sont plus souvent infectés puisque les momies sont des sites de survie pour l’inoculum. Les variétés résistantes à la tavelure (Vf) sont souvent très sensibles à la suie-moucheture (ex. : Topaz, Liberty).
Sensibilité à la suie-moucheture de quelques variétés tirées du projet NE-18349 et cultivées au Québec :
Hâtifs :
Sunrise tolérant
Gingergold sensible
Zestar! tolérant
Mi saison :
Gala sensible
HoneyCrisp sensible
McIntosh sensible
Tardives :
Ambrosia très sensible
Fuji très sensible
Golden Delicious très sensible
Pinova sensible
Taille
La densité de plantation n’a pas d’impact sur l’incidence de la maladie47, mais l’effet de la densité des branches sur la gravité de la maladie est reconnu depuis longtemps. On observe régulièrement que la suie est plus fréquente dans les vergers peu ou mal taillés6,39,50,51. Dans les pommiers où la taille permet en général une meilleure circulation de l’air, la maladie est presque toujours moins grave que dans les pommiers non taillés24,52. L’effet de la taille d’été sur le micro climat dans les vergers est important. Dans les vergers taillés, le nombre d’heures pendant lesquelles l’humidité relative est élevée est beaucoup moindre que dans les vergers non taillés53. L’effet sur la maladie est facilement constaté dans les vergers où les traitements d’été sont peu fréquents50,53. Cependant, la taille n’a pas un grand effet sur la moucheture dans les vergers où des traitements fongicides sont appliqués régulièrement durant tout l’été53. Comme la taille est pratiquée dans tous les vergers commerciaux, les tentatives de contrer la maladie seulement par une modification des pratiques d’émondage n’ont donc pas donné de résultats probants. La taille reste cependant une excellente composante d’une stratégie complète de lutte contre le SBFS et facilite l’adoption des stratégies avec traitements réduits (ex. : par l’utilisation des modèles36).
Éclaircissage
Réduire le nombre de bouquets avec plusieurs fruits peut réduire l’incidence du SBFS54 et limiter la possibilité de symptômes dans la zone du pédoncule. Cependant, la maladie peut être amplifiée si la technique d’éclaircissage favorise la formation des momies (ex. : NAA sous de mauvaises conditions).
Engrais
Les excès d’azote sont associés à une augmentation de la suie-moucheture51. De même, les engrais d’été à base de phosphore (Phosyn Hydrophos, Yara) appliqués avant la récolte peuvent aggraver la suie5. À l’inverse, des traitements à répétition de chlorure de calcium en été réduisent substantiellement les problèmes de suie-moucheture1,55,56. Les traitements doivent démarrer tôt et ne sont pas aussi efficaces que les traitements fongicides mais les bénéfices du calcium sont nombreux. Voir la fiche sur la fertilisation.
Toile réfléchissante
Une toile tissée réfléchissante blanche appliquée au sol pour améliorer la couleur des fruits peut réduire de façon importante l’incidence de la suie5.
Filets
La culture de pommes sous filets attenue fortement la présence de suie-moucheture4,29,57,58. Les filets diminuent le nombre de micro fissures (craquelage microscopique) à la surface des fruits, ce qui réduit la fuite de sucres qui nourrissent les champignons.
Ensachage
Différentes expériences d’ensachage de fruits individuels ont été réalisées pour préciser la période critique pour les infections18,24–26. Il pourrait être possible d’appliquer cette technique pour réprimer la maladie à condition que le fruit (poire ou pomme) s’y prête et que le cout de la main d’œuvre ne soit pas prohibitif. Les sacs ont deux effets : ils empêchent les spores d’atteindre les fruits et ils atténuent l’infection des fruits déjà contaminés au moment de la pose26. Comme d’assez courtes périodes d’exposition des fruits (7 heures de mouillure) peuvent augmenter significativement l’infection25, les sacs (ex. : sacs Fuji) doivent être installés tôt et demeurer sur les fruits jusqu’à la récolte. Même si les symptômes sont fortement atténués, la méthode n’est pas toujours entièrement efficace et il arrive parfois que le champignon arrivé avant la pose des sacs1 se développe sur les fruits dans l’eau de condensation.
Irrigation
Les systèmes par aspersion peuvent facilement favoriser la dispersion de la maladie33. Dans les vergers où l’approvisionnement en eau est facile et où le refroidissement par évaporation est une possibilité, les risques accrus de suie-moucheture sont à considérer.
Gestion de la maladie : traitements fongicides
Pulvérisation
La plupart des traitements phytosanitaires, les engrais et les hormones sont appliqués sur les arbres avant que toutes les feuilles de l’année soient en place. Les réglages qui fonctionnent pour une canopée printanière « poreuse » doivent être ajustés en été pour assurer une bonne couverture des fruits, notamment la face cachée des fruits et la zone du pédoncule. La mauvaise qualité de pulvérisation est un facteur reconnu d’aggravation des problèmes de SBFS31. Les traitements à faible volume d’eau peuvent très bien couvrir les fruits et les petites gouttelettes couvrent mieux les fruits que les grosses gouttes. Il n’est pas nécessaire d’augmenter le volume de bouillie pour augmenter la couverture comme le suggère certains auteurs2,50. La clef est de calibrer correctement l’appareil, d’ajuster le débit d’air et la vitesse d’avancement et s’assurer que la bouillie puisse atteindre la cible en taillant les vergers adéquatement. Dans les vergers où le nombre d’applications est optimisé en fonction des risques, une bonne couverture devient encore plus importante parce que les failles de couverture du pulvérisateur ne sont pas compensées par la fréquence des traitements.
Période des traitements
Les premiers traitements fongicides de l’année n’ont pas d’effet contre la suie-moucheture59, mais les traitements dirigés contre les dernières infections de tavelure primaire répriment très bien les premières infections de SBFS60,61. Cependant, lorsque les conditions en été sont favorables au SBFS on observe des pertes parfois importantes dans les vergers où les traitements fongicides sont réduits (ex. : pommiers résistants à la tavelure) et dans les sites avec une forte réduction des traitements fongicide en été. Une stratégie estivale de traitements fongicides dirigée contre le SBFS et préférablement adaptée à la météo est parfois requise dans les sites où la maladie est un problème. Comme les pourritures d’été62 ne sont problématiques au Québec, il est possible de cibler les traitements d’été exclusivement en fonction de la suie-moucheture en utilisant les modèles décrits plus haut. Les traitements en début d’été ont souvent plus d’impact que les traitements proches de la récolte parce que les infections tardives ne sont pas suivies d’assez d’heures d’humectation pour que les symptômes apparaissent.
Fongicides homologués et/ou efficaces
Les problèmes de suie-moucheture et notamment certaines variantes de la suie semblent avoir pris de l’ampleur lors de l’abandon des fongicides minéraux (ex. : cuivre) au profit des fongicides issus de la chimie organique18 (captan, mancozeb) au milieu du 20e siècle. Le même phénomène d’augmentation a été observé lors de l’abandon des Benzimidazoles (ex. : benomyl, BENLATE) qui étaient très efficaces et ensuite lors de l’adoption massive des premiers inhibiteurs de stérols (ex. : NOVA, NUSTAR) qui n’avaient pas d’efficacité contre le SBFS46,47. Finalement, l’ajout de restrictions sur l’utilisation des EBDC (mancozèbe) en été a également contribué à l’essor de cette maladie47 parce que le Captan utilisé comme remplacement était moins efficace.
Malgré tout, les fongicides usuels homologués sur le pommier sont efficaces contre les champignons responsables de la suie et dans une moindre mesure ceux de la moucheture34,38, à condition de bien les utiliser :
Les fongicides peuvent ralentir la suie-moucheture mais peuvent difficilement déloger des colonies en croissance et encore moins effacer des dommages déjà visibles. Idéalement, les traitements devraient donc être faits en lien avec l’arrivée des spores sur les fruits et l’infection, au moment où le champignon est le plus vulnérable. Les traitements « classiques » de type « calendrier » de 3 ou 4 traitements espacés de 3 ou 4 semaines dans les mois d’été ne suffisent pas toujours à maintenir la maladie à des seuils commercialement acceptables47, probablement parce qu’ils sont appliqués sur des colonies invisibles déjà bien accrochées. Dans tous les cas, les traitements fongicides doivent précéder l’apparition des symptômes puisque les fongicides ne sont pas « curatifs ». De plus, aucun traitement n’a d’effet prolongé en post infection34,46. Les traitements sont au mieux « fongistatiques ». C’est-à-dire que les champignons ne sont pas tués mais seulement temporairement arrêtés. Les champignons reprennent leur croissance après lessivage du traitement et l’apparition des symptômes a quand même lieu, parfois après la récolte. Les traitements en place peuvent cependant protéger contre les nouvelles infections.
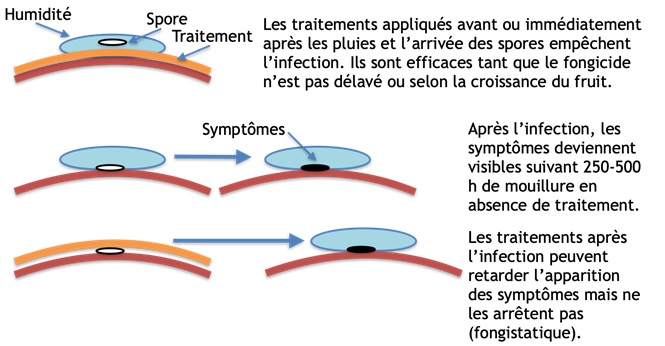
Figure 4. Représentation de l’effet des traitements sur les spores. En haut : traitement préventif, en bas : traitement en post infection.
Fongicides admissibles en production biologique
Bicarbonate de potassium : Lorsque les traitements sont dirigés contre les infections (ex. : avec RIMpro) ou lorsque les traitements sont nombreux (ex. : à chaque 2 semaines63), le bicarbonate de potassium est efficace contre la suie-moucheture. Le bicarbonate n’est pas efficace autrement56. Le bicarbonate formulé ou en mélange avec le soufre est plus efficace que le bicarbonate alimentaire.
Bicarbonate formulé (Milstop) : Le Kaligreen36 appliqué à raison de 2,8 kg/ha actif aux 14 jours selon une stratégie « calendrier », était moins efficace que les traitements conventionnels. Par contre, le Armicarb63 appliqué à 5 kg/ha aux deux semaines s’est avéré très efficace. Cependant, Armicarb peut causer des taches lenticellaires à un niveau inacceptable10.
Bicarbonate + huile : Efficace contre les deux maladies64. Cependant, l’ajout d’huile rend cette option incompatible avec d’autres traitements.
Cuivre (bouillie bordelaise) : Une des premières méthodes de contrôle confirmée6. En Europe, le Kocide (hydroxyde) est régulièrement employé contre le SBFS. Cependant, les doses très réduites en usage contre la tavelure ne seraient pas assez efficaces.
Soufre : Le soufre seul a une efficacité moyenne contre la moucheture64, mais pas contre la suie54,64.
Bouillie soufrée6 : Aussi efficace que le standard commercial à 14 L/ha, mais peut induire une phytotoxicité. À la dose de 7 L/ha, le produit n’est pas phytotoxique et aussi efficace que le standard commercial lorsque les intervalles entre les applications sont réduits. Cependant, des résidus peuvent être visibles sur les fruits à la récolte65. De plus, la bouillie soufrée peut augmenter les problèmes de pourriture noire et n’a pas d’effet contre la pourriture amère38,66.
Peroxyde (Oxidate) : Le « nettoyage » à intervalles réguliers des colonies de suie-moucheture avec du peroxyde est envisageable mais le nombre d’essais publié est limité.
Myco-san : En Europe, cette formulation d’argile et de soufre a une efficacité partielle contre la SBFS10.
D’autres produits, notamment des produits bio (ex.& : Cocana63,65,67, methionine64) ont été testés avec plus ou moins de succès et ne sont pas homologués au Canada.
Fongicides synthétiques classiques
Captan31,68 : Plus efficace contre la suie que la moucheture. Lorsque les intervalles d’application sont espacés de 14 jours ou plus, la dose maximale de l’étiquette peut être nécessaire. Des applications ciblées à dose plus faibles sont préférables. Une application non ciblée de 2 kg/ha de Captan aux 3 semaines jusqu’à la mi-août peut être insuffisante lorsque la saison est pluvieuse avant la récolte34.
Folpan (Très similaire au Captan)
Fluazinam69 (Allegro) : Efficacité variable selon les espèces, mais utile.
Mancozeb, Metiram (EBDC)31 : Plus efficace contre la moucheture que la suie. Aux doses usuelles, les EBDC sont plus efficaces que le Captan pour réprimer la suie-moucheture. Cependant, le délai d’application actuellement de 77 jours avant récolte est restrictif pour permettre une gestion efficace de la maladie. Selon la quantité appliquée lors du dernier traitement et des conditions locales, l’activité résiduelle peut maintenir une protection pendant plusieurs semaines31.
Fongicides synthétiques fongistatiques
Tant que les fruits sont couverts par ces produits, l’expression des symptômes de suie-moucheture est retardée. Entre le lessivage des produits et l’apparition des symptômes, il peut s’écouler 270 heures de mouillure selon le moment de l’infection. Si l’infection était déjà prête à apparaître au moment du traitement, les symptômes apparaîtront rapidement après lessivage. En absence de lessivage et à condition que les fruits demeurent secs après récolte, ces traitements peuvent retarder « indéfiniment » la sortie des symptômes. Cet avantage a cependant quelques conséquences : tous les produits fongistatiques sont plus chers, sont à risque de résistance ou ont un effet indésirable en PFI.
Benzimidazoles (groupe 1) : Le thiophanate-methyl (Senator) est très efficace pour ralentir la sortie des symptômes. Ce fongicide a été abandonné pour lutter contre la tavelure à cause de la résistance, mais pourrait être utilisé contre d’autres maladies comme le SBFS. Il n’est pas recommandé en PFI parce que son usage est dévastateur contre les populations de vers de terre et les prédateurs d’acariens70.
Dodine (groupe U12) : Efficace en verger pour plusieurs champignons impliqués24, mais probablement seulement contre la suie. L’utilisation en été pourrait accélérer la résistance de la tavelure.
QoI (groupe 11) : Les strobilurines (ex. : Flint, Sovran) sont très efficaces34,36,61 ex. : Flint 140 g/ha. Une possibilité à considérer si la tavelure est résistante ou que l’usage contre la tavelure n’est pas prévu. Application efficace pour 21 jours ou 50 mm de pluie.
SDHI (groupe 7) : Tous les produits (ex. : Fontelis, Aprovia) sont efficaces contre la suie moucheture, même s’ils ne sont pas nécessairement homologués. Gestion de la résistance : leur usage devrait être réservé pour la tavelure.
Inspire Super (groupe 3) : Contrairement aux autres IBS (ex. : NOVA) , la portion « difénoconazole » de ce mélange est très efficace contre le SBFS60,71,72. La persistence des traitements est d’environ 2 semaines à la dose de 900 mL/ha par application62. Gestion de la résistance : ce produit devrait être réservé à la tavelure.
Autres
Phosphite (phosphonate, ex. : phostrol) : Très efficace en mélange avec le Captan contre le SBFS73, mais pas suffisante quand le produit est utilisé seul. Par ailleurs, les phosphites sont très persistants et s’accumulent dans les arbres pendant des années. Cet aspect pourrait devenir problématique si les résidus fongicides sont mesurés.
Interventions après récolte
Entreposage
Il est possible de gérer le risque d’apparition de la maladie en évaluant les lots de pommes à leur arrivée (voir la section sur les pommes sentinelles) et d’écouler les fruits à risque en les stockant dans des chambres froides plus « sèches » qui empêcheront la sortie des symptômes. Pour limiter les pertes de volume, les fruits avec des symptômes déjà apparents destinés à la transformation ne devraient pas être stockés.
Bassinage au chlore et brossage
L’une des plus anciennes méthode rapportée pour éliminer les symptômes sur les fruits consistait en l’immersion des fruits pendant 6 minutes dans une solution de « Chlorure de chaux » (CaCl2 + Ca(ClO)2) (eau de Javel) et de bicarbonate de sodium6. Plus récemment, une solution d’hypochlorite de sodium ou de calcium a été testé avec succès74. Ces auteurs ont rapporté qu’un bassinage de 5 minutes dans une solution de 940 ppm de chlore suffisait pour complètement éliminer la suie et une bonne partie des mouchetures malgré une forte sévérité de la maladie. Le bassinage n’était pas phytotoxique et n’a pas eu d’effet sur le fini des fruits. Le trempage dans une solution à 500 ppm de chlore suivi d’un brossage avait le même effet. Dans d’autres tests à plus grande échelle75, le bassinage dans une solution à une concentration de 800 ppm de chlore libre (hypochlorite tamponné à un pH de 6,5) pendant 7 minutes suivi de brossage et de rinçage à l’eau pour un total de 30 secondes étaient requis pour obtenir 100 % de fruits de qualité « extra fancy ». Une concentration de 200 à 500 ppm de chlore donnait respectivement de 92 % à 96,5 % de fruits « extra fancy ». Une solution à 500 ppm est équivalente à 0,4 L d’eau de Javel à 12,5 % dans 100 L d’eau. Cette concentration de chlore est élevée par rapport aux usages habituels en post-récolte pour la pomme (100-150 ppm)76, mais néanmoins réaliste. La méthode serait d’ailleurs largement utilisée1. Il est possible qu’une concentration moindre de chlore puisse suffire sur des fruits présentant moins de symptômes. Des variantes comme le mélange d’eau de Javel (300 ppm) et de bicarbonate de sodium (1 %) fonctionnent aussi77. Le bassinage au chlore pourrait être plus ou moins difficile selon les espèces de champignon présentes1,75. Le bassinage au chlore a aussi l’avantage de réduire plusieurs résidus de pesticides à la surface des fruits74,78. Par contre, cette approche n’est pas admissible en production biologique même avec un rinçage intensif79.
Alternatives au chlore
Le brossage des fruits sans trempage6,75 peut réduire partiellement la maladie mais n’est pas assez efficace à moins que le système soit optimisé pour cet usage et que les fruits soient préalablement classés par diamètre pour maximiser l’efficacité des brosses4. De plus, des différences entre cultivars sont possibles. Par exemple, le brossage après trempage était plus efficace avec le cultivar Jonathan et McIntosh qu’avec Golden Delicious75. Le brossage avec des traitements sans chlore comme le peroxyde et le savon75, ainsi que l’application de cire77 ont aussi été testés, mais n’étaient pas aussi efficaces. Les traitements à l’eau chaude communs chez les producteurs bio en Europe80 ou de vinaigre4 en combinaison avec le brossage sont aussi à considérer. Pour toutes les méthodes de nettoyage des fruits après la récolte, il est possible que l’âge des symptômes puissent affecter les résultats. Les colonies les plus vieilles sont vraisemblablement plus fortement incrustées dans la cire et la cuticule des fruits. Des traitements fongicides ciblés en début de saison et un nettoyage des fruits en cas d’infection tardive pourrait être une stratégie à envisager pour éviter les résidus de traitements trop proches de la récolte.
Stratégie combinée (résumé) : Pour minimiser les risques de suie-moucheture sans avoir recours à des traitements réguliers, une stratégie « PFI » débute par l’adoption d’un maximum des pratiques couvertes dans la section « prévention », incluant une mise à jour des techniques de pulvérisation. Les traitements fongicides en été ne devraient être appliqués que dans les vergers où la maladie a déjà été observée. Le suivi de pommes sentinelles et/ou des modèles peuvent ensuite être utilisés pour initier les traitements d’été. La fréquence des traitements nécessaire devrait dépendre à la fois du lessivage des produits, du grossissement des fruits depuis le dernier traitement, mais aussi du risque d’infection. Des traitements liés aux périodes de pluie assez intenses pour éclabousser les spores devraient suffire pour empêcher la propagation de la maladie. Plusieurs fongicides sont efficaces contre la suie et il est possible de choisir une stratégie qui ne mettra pas en péril l’efficacité des produits utilisés pour lutter contre la tavelure. Les premiers traitements (ex. : juin) sont beaucoup plus utiles que les traitements proches de la récolte. Après récolte, évitez les chambres très humides pour les lots à risque. Les pommes sentinelles peuvent aider à gérer les lots. Le brossage et le lavage des pommes avec des symptômes « frais » est à considérer.
Références
- Gleason, M. L. et al. A New View of Sooty Blotch and Flyspeck. Plant Dis. 95, 368–383 (2011).
- Williamson, S. M. & Sutton, T. B. Sooty blotch and flyspeck of apple: etiology, biology, and control. Plant Dis. 84, 714–724 (2000).
- Sutton, A. L. & Sutton, T. B. The distribution of the mycelial types of Gloeodes pomigena on apples in North Carolina and their relationship to environmental conditions. Plant Dis. (1994).
- Kelderer, M., Casera, C., Vargas, A. M. & Öttl, S. Approaches how to reduce sooty mold on organically produced apples. in Ecofruit 41–46 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2020).
- Toivonen, P. M. A., Lu, C. & Stoochnoff, J. Postharvest quality implications of preharvest treatments applied to enhance AmbrosiaTM apple red blush colour at harvest. Can. J. Plant Sci. 99, 40–49 (2019).
- Colby, A. S. Sooty blotch of pomaceous fruits. (University of Illinois, 1919).
- Weber, R. W. S., Späth, S., Buchleither, S. & Mayr, U. A review of sooty blotch and flyspeck disease in german organic apple production. Erwerbs-Obstbau 58, 1–17 (2016).
- Cooley, D. R. et al. Variability among forecast models for the apple sooty blotch/flyspeck disease complex. Plant Dis. 95, 1179–1186 (2011).
- Trapman, M. Observations on the epidemiology of sooty blotch in organic orchards in the Netherlands. in Ecofruit 125–132 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2006).
- Miñarro, M., Blázquez, M. D. & Dapena, E. Pest status of the sooty blotch and flyspeck complex in Asturian (NW Spain) apple orchards. in Ecofruit vol. 4753 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2012).
- Johnson, E. M., Sutton, T. B. & Hodges, C. S. Peltaster fructicola: a new species in the complex of fungi causing apple sooty blotch disease. Mycologia 114–120 (1996).
- Gleason, M. L., Zhang, R., Batzer, J. C. & Sun, G. Stealth pathogens: the sooty blotch and flyspeck fungal complex. Annu. Rev. Phytopathol. 57, 135–164 (2019).
- Batzer, J. C., Sisson, A. J., Harrington, T. C., Mayfield, D. A. & Gleason, M. L. Temporal patterns in appearance of sooty blotch and flyspeck fungi on apples. Microb. Ecol. 64, 928–941 (2012).
- Díaz Arias, M. M. et al. Diversity and biogeography of sooty blotch and flyspeck fungi on apple in the eastern and midwestern United States. Phytopathology 100, 345–355 (2010).
- Batzer, J. C. et al. Four species of Zygophiala (Schizothyriaceae, Capnodiales) are associated with the sooty blotch and flyspeck complex on apple. Mycologia 100, 246–258 (2008).
- Madeiras, A. M. Identification and Epidemiological Features of Important Fungal Species Causing Sooty Blotch on Apples in the Northeastern United States. (University of Massachusetts Amherst, 2014).
- Batzer, J. C., Stensvand, A., Mayfield, D. A. & Gleason, M. L. Composition of the sooty blotch and flyspeck complex on apple in Norway is influenced by location and management practices. Eur. J. Plant Pathol. 141, 361–374 (2014).
- Groves, A. B. Sooty Blotch and Fly Speck. Yearb. Agric. 663 (1953).
- Baker, K. F., Davis, L. H., Durbin, R. D. & Snyder, W. C. Greasy blotch of carnation and flyspeck of apple-diseases caused by zygophiala-jamaicensis. Phytopathology 67, 580–588 (1977).
- Ocamb-Basu, C. M. & Sutton, T. B. Effects of temperature and relative humidity on germination, growth, and sporulation of Zygophiala jamaicensis. Phytopathology 78, 100–103 (1988).
- Cooley, D. R., Lerner, S. M. & Tuttle, A. F. Maturation of thyriothecia of Schizothyrium pomi on the reservoir host Rubus allegheniensis. Plant Dis. 91, 136–141 (2007).
- Johnson, E. M. & Sutton, T. B. Response of two fungi in the apple sooty blotch complex to temperature and relative humidity. Phytopathology 90, 362–367 (2000).
- Batzer, J. C. et al. Effect of temperature and nutrient concentration on the growth of six species of sooty blotch and flyspeck fungi. Phytopathol. Mediterr. 49, 3–10 (2010).
- Latham, A. J. & Hollingsworth, M. H. Incidence and control of sooty blotch and fly speck on apples in Alabama. (1973).
- Smigell, C. & Hartman, J. Evaluation of multi-layer fruit bags for cork spot, sooty blotch, and flyspeck control, 1997. 1998 Fruit Veg. Crops Res. Rep. 13 (1998).
- Ismail, S. I., Batzer, J. C., Harrington, T. C. & Gleason, M. L. Phenology of infection on apple fruit by sooty blotch and flyspeck species in iowa apple orchards. Plant Dis. 100, 352–359 (2016).
- Xu, C. et al. Peltaster fructicola genome reveals evolution from an invasive phytopathogen to an ectophytic parasite. Sci. Rep. 6, 1–13 (2016).
- Wrona, B. & Grabowski, M. Etiology of apple sooty blotch in Poland. J. Plant Prot. Res. 44, 293–297 (2004).
- Chouinard, G. et al. Impact of exclusion netting row covers on ‘Honeycrisp’ apple trees grown under northeastern North American conditions: Effects on photosynthesis and fruit quality. Insects 10, 214 (2019).
- Belding, R. D., Sutton, T. B., Blankenship, S. M. & Young, E. Relationship between apple fruit epicuticular wax and growth of Peltaster fructicola and Leptodontidium elatius, two fungi that cause sooty blotch disease. Plant Dis. 84, 767–772 (2000).
- Brown, E. M. & Sutton, T. B. Control of sooty blotch and flyspeck of apple with captan, mancozeh, and mancozes combined with dinocap in dilute and concentrate applications. Plant Dis. 70, 281–284 (1986).
- Gao, L., Sun, G., Zhang, R. & Gleason, M. L. Secondary spread of Zygophiala wisconsinensis on the surface of apple fruit. Eur. J. Plant Pathol. 139, 117–124 (2014).
- Rosli, H. et al. Precipitation Impacts Dissemination of Three Sooty Blotch and Flyspeck Taxa on Apple Fruit. Plant Dis. 104, 2398–2405 (2020).
- Rosenberger, D. A. & Meyer, F. W. Timing summer fungicides to control flyspeck disease on apples. N. Y. Fruit Q. 15, 11–14 (2007).
- Trapman, M. A simulation program for the timing of fungicides to control sooty blotch in organic apple growing. First results in 2003. in Ecofruit 56–66 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2004).
- Babadoost, M., McManus, P. S., Helland, S. N. & Gleason, M. L. Evaluating a wetness-based warning system and reduced-risk fungicides to manage sooty blotch and flyspeck of apple. HortTechnology 14, 51–57 (2004).
- Duttweiler, K. B. et al. Adaptation of an apple sooty blotch and flyspeck warning system for the Upper Midwest United States. Plant Dis. 92, 1215–1222 (2008).
- Rosenberger, D. & Cox, K. Integration of OMRI-Approved Fungicides, Sanitation, and Cultural Controls for Managing Summer Diseases on Apples. (2010).
- Ellis, M. A., Madden, L. V. & Wilson, L. L. Evaluation of an empirical model for predicting sooty blotch and flyspeck of apples in Ohio. 29–33 (1999). Disponible sur : http://kb.osu.edu/dspace/bitstream/handle/1811/70766/OARDC_research_circular_n299.pdf?sequence=1#page=31.
- Brown, E. M. & Sutton, T. B. An empirical model for predicting the first symptoms of sooty blotch and flyspeck of apples. Plant Dis. 79, 1165–1168 (1995).
- Hall, J. C., Frank, M., Tuttle, A. F. & Cooley, D. R. Can we predict flyspeck development? Fruit Notes 62, 21 (1997).
- Batzer, J. C., Gleason, M. L., Taylor, S. E., Koehler, K. J. & Monteiro, J. Spatial heterogeneity of leaf wetness duration in apple trees and its influence on performance of a warning system for sooty blotch and flyspeck. Plant Dis. 92, 164–170 (2008).
- Rosli, H. et al. Evaluating the performance of a relative humidity-based warning system for sooty blotch and flyspeck in Iowa. Plant Dis. 101, 1721–1728 (2017).
- Hickey, K. D. & others. sooty blotch and fly speck diseases of apple with emphasis on variation within Gloeodes pomigena (Schw.) Colby. (1960).
- Buchleither, S., Späth, S., Bohr, A. & Mayr, U. Disease development of sooty blotch and its correlation to wetness hours. in Proceedings of the 15th International Conference on Organic Fruit-Growing vol. 5460 (2012).
- Brown, E. M. & Sutton, T. B. Time of infection of Gloeodes pomigena and Schizothyrium pomi on apple in North Carolina and potential control by an eradicant spray program. Plant Dis. 77, 451–455 (1993).
- Rosenberger, D. A., Engle, C. A. & Meyer, F. W. Effects of management practices and fungicides on sooty blotch and flyspeck diseases and productivity of Liberty apples. Plant Dis. 80, 798–803 (1996).
- Beer, M., Brockamp, L. & Weber, R. W. Control of sooty blotch and black rot of apple through removal of fruit mummies. Folia Hortic. 27, (2015).
- Biggs, A. R., Cooley, D. R., Rosenberger, D. A. & Yoder, K. S. Relative Susceptibility of Selected Apple Cultivars to Sooty Blotch and Flyspeck. Plant Health Prog. (2010) doi:10.1094/PHP-2010-0726-01-RS.
- Batzer, J. C., McManus, P. S. & Gleason, M. L. Fungicide Spray Volume and Pruning Impact Performance of a Warning System for Sooty Blotch and Flyspeck on Apple. Plant Health Prog. (2013) doi:10.1094/PHP-2013-0930-01-RS.
- Trapman, M. & Jansonius, P. J. Disease management in organic apple orchards is more than applying the right product at the correct time. in Ecofruit 16–22 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2008).
- Ocamb-Basu, C. M., Sutton, T. B. & Nelson, L. A. The effects of pruning on incidence and severity of Zygophiala jamaicensis and Gloeodes pomigena infections of apple fruit. Phytopathology 78, 1004–1008 (1988).
- Cooley, D. R., Gamble, J. W. & Autio, W. R. Summer pruning as a method for reducing flyspeck disease on apple fruit. Plant Dis. 81, 1123–1126 (1997).
- Sutton, T. B. & Williamson, S. M. Sooty Blotch of Apple: Etiology and Management. in Ecofruit 43–48 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2002).
- Biggs, A. R. Effects of Calcium Salts on Apple Bitter Rot Caused by Two Colletotrichum spp. Plant Dis. 83, 1001–1005 (1999).
- Cooley, D. R., Autio, W. R., Tuttle, A. & Krupa, J. Alternative fungicides for management of sooty blotch and flyspeck. Fruit Notes 71, 3 (2006).
- Chouinard, G. et al. Impact of exclusion netting row covers on arthropod presence and crop damage to ‘Honeycrisp’ apple trees in North America: A five-year study. Crop Prot. 98, 248–254 (2017).
- Boutry, C., Baumgartner, F. & Friedli, M. Testing the effect of a rainproof protection net on the apple production regarding disease and pest damages. in Ecofruit 95–98 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2020).
- Trapman, M., Tamm, L. & Fuchs, J. G. The effectiveness of winter treatments with copper or lime sulphur to control Sooty Blotch on apple. in Ecofruit 67–72 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2004).
- Rosenberger, D., Meyer, F. W. & Rugh, A. L. Effectiveness of new SI and strobilurin fungicides and combinations, 2007. Fungic. Nematic. Tests Results – Am. Phytopathol. Soc. 2, PF026 (2008).
- Yoder, K. S., Cochran, A. E., Royston, W. S., Kilmer, S. W. & Brumback, L. Disease control by experimental fungicides on ‘Golden Delicious’ and ‘Rome Beauty’ apples, 2006. Fungic. Nematic. Tests Results – Am. Phytopathol. Soc. 1, (2007).
- Rosenberger, D., Cox, K., Rugh, A., Villani, S. & Fredericks, Z. A New Fungicide for Controlling Summer Diseases on Apples? N. Y. Fruit Q. 20, 9–13 (2012).
- Tamm, L., Amsler, T., Schärer, H. & Refardt, M. Efficacy of Armicarb (potassium bicarbonate) against scab and sooty blotch on apples. in Ecofruit 87–92 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2006).
- Andrews, J. H., O’Mara, J. K. & McManus, P. S. Methionine-riboflavin and potassium bicarbonate-polymer sprays control apple flyspeck and sooty blotch. Plant Health Prog. (2001) doi:10.1094/PHP-2001-0706-01-RS.
- Fuchs, J. G., Haseli, A. & Tamm, L. Influence of application strategy of coconut soap on the development of sooty blotch on apple. in Ecofruit 50–54 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2002).
- Lalancette, N., Blaus, L. & Feldman, P. Evaluation of Serenade Optimum and Lime-Sulfur for Disease Management in Organic Apple Orchards. Fruit Notes 82, 9–13 (2017)
- Mayr, U. & Späth, S. Sooty blotch of apple: Efficacy of different application strategies. in Ecofruit 82–86 (Fördergemeinschaft Ökologischer Obstbau eV (FÖKO), 2008).
- Andes, J. O., Epps, J. M., & others. Evaluation of fungicides for control of fruit diseases. (1956).
- Tarnowski, T., Batzer, J., Gleason, M. L., Helland, S. & Dixon, P. Sensitivity of newly identified clades in the sooty blotch and flyspeck complex on apple to thiophanate-methyl and ziram. Plant Health Prog. (2003).
- Pest Management Regulatory Agency. Re-evaluation Decision RVD2020-13, Thiophanate-methyl and Its Associated End-use Products. Pest Control Products Act vols RVD2020-13 ISSN: 1925-1025 (2020).
- Sutton, B. T., Brown, E. & Anas, O. Summer disease control with A7402T (difenoconazole), 2006. Fungic. Nematic. Tests Results – Am. Phytopathol. Soc. 1, (2007).
- Travis, J. W., Halbrendt, N. O., Lehman, B. & Jarjour, B. Evaluation of Captan/Topsin program and the experimental fungicide difenoconazole for the control of sooty blotch, flyspeck, and rots, 2006. Plant Dis. Manag. Rep. 1, (2007).
- Rosenberger, D. A., Cox, K. D. & Highland, N. Y. Using phosphite fungicides to control apple diseases. N. Y. Fruit Q. 17, 9–13 (2009).
- Hendrix, F. F. Removal of sooty blotch and flyspeck from apple fruit with a chlorine dip. Plant Dis. 75, 742–743 (1991).
- Batzer, J. C., Gleason, M. L., Weldon, B., Dixon, P. M. & Nutter Jr, F. W. Evaluation of postharvest removal of sooty blotch and flyspeck on apples using sodium hypochlorite, hydrogen peroxide with peroxyacetic acid, and soap. Plant Dis. 86, 1325–1332 (2002).
- Suslow, T. Chlorination in the production and postharvest handling of fresh fruits and vegetables. (2005).
- Ashraf, S., Ahmad, Q. N. & Ahmad, S. Impact of post harvest chemical dip and wax coating on sooty blotch and fly speck disease complex of apple. Appl. Biol. Res. 8, 44–46 (2006).
- Ong, K. C., Cash, J. N., Zabik, M. J., Siddiq, M. & Jones, A. L. Chlorine and ozone washes for pesticide removal from apples and processed apple sauce. Food Chem. 55, 153–160 (1996).
- The use of chlorine materials in organic production and handling. USDA NOP vol. 5026 (2011).
- Schloffer, K. & Trapman, M. Hot water shower against Gloeosporium fruit rot in organic apple production – how to introduce a new system from research to practice. IOBC-WPRS Bull. 110, 191–198 (2015).
Cette fiche est une mise à jour de la fiche originale du Guide de référence en production fruitière intégrée à l’intention des producteurs de pommes du Québec 2015. © Institut de recherche et de développement en agroenvironnement. Reproduction interdite sans autorisation.




Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !