Auteur de la première édition : Vincent Philion
Auteurs de la mise à jour 2024 : Vincent Philion
Dernière mise à jour par l’auteur : 23 décembre 2023
Cet ennemi du pommier est réglementé en vertu de la Loi sur la protection sanitaire des cultures (voir la fiche sur Le « droit de produire » et la loi) et les mesures nécessaires doivent être prises pour éviter la propagation aux cultures avoisinantes.
En 1862, le premier guide de production à l’intention des producteurs du Québec1 ne faisait même pas mention de la tavelure du pommier. Au début du siècle dernier (années 1900), environ trois traitements fongicides appliqués pendant la période des infections primaires avec des produits moins efficaces que ceux disponibles aujourd’hui suffisaient pour réprimer efficacement la tavelure du pommier. Dans les années 1980, c’est un traitement par semaine qui était requis pour réprimer les infections.
Ces stratégies de traitement très allégées conduiraient actuellement à des résultats inacceptables dans la plupart des vergers commerciaux. Différents facteurs expliquent l’augmentation des problèmes de tavelure et leur compréhension est la clef pour intégrer autant que possible des stratégies pour mieux gérer la tavelure à l’avenir. La présente fiche a pour but d’expliquer brièvement l’historique de la situation actuelle et comment modifier les pratiques pour assurer une meilleure gestion de la maladie.
La gestion de la tavelure ne se résume pas aux traitements fongicides. Une bonne compréhension de la biologie de la tavelure et l’intégration de plusieurs stratégies de lutte décrites dans cette fiche sont nécessaires pour gérer cette maladie de façon optimale et à moindre coût. Les stratégies de traitements fongicides au printemps et en été sont traitées aux fiches sur La tavelure : traitements contre les infections primaires et La tavelure : traitements d’été.
Choix des cultivars
La production intensive popularisée au cours du dernier siècle a mené le plus souvent à des blocs monovariétaux qui facilitent une sélection des races de tavelure les mieux adaptées à ces cultivars2. Par exemple, les blocs de vergers de McIntosh au Québec contribuent à produire des souches de tavelure parfaitement adaptées à ce cultivar et conséquemment à des épidémies graves de la maladie, alors que la McIntosh semble presque résistante ou du moins tolérante dans les pays où ce cultivar n’est pas produit en masse. À l’inverse, la Golden Delicious est très sensible à la tavelure européenne, mais elle est beaucoup moins sensible aux races de tavelure produites au Québec, simplement parce que ce cultivar n’est pas planté à grande échelle ici. Les cultivars anciens qui sont tolérants aux races de tavelure présentes actuellement pourraient devenir tout aussi sensibles que la McIntosh si leur culture était intensifiée. La règle est universelle : chaque introduction d’un cultivar et son adoption massive mène inévitablement à une spécialisation de la tavelure pour ce cultivar.
Il est difficile de prévoir jusqu’à quel point la génétique d’un cultivar est assez robuste pour limiter cette spécialisation. Il est possible que des cultivars comme Spartan et Honeycrisp3, qui sont actuellement moins affectés par la tavelure, demeurent relativement « tolérants » à long terme même si une augmentation de la tavelure est perceptible depuis leur introduction. Mais ils pourraient, au cours du temps, devenir aussi sensibles que la McIntosh si l’intensification de leur production continue. Néanmoins, la fréquence des traitements souvent adaptée aux cultivars les plus sensibles pourrait être réduite selon les cultivars puisque l’augmentation de la sensibilité dans le temps peut prendre des décennies.
Tel qu’indiqué en introduction générale, le mode de production PFI et la commercialisation axée sur des cultivars connus du public limite les possibilités pour contrer le phénomène de la spécialisation des races. Sans revenir à une production extensive ou choisir des cultivars tolérants qui ne correspondent pas au marché souhaité, la première ligne de défense pour limiter la sévérité des attaques de tavelure consiste à augmenter la diversité variétale dans les vergers. Augmenter la diversité des cultivars empêche la spécialisation des races de tavelure et donc diminue directement l’apparition des symptômes (voir incubation), et indirectement la propagation et l’apparition de tavelure sur fruits. La diversité des cultivars n’empêche pas la production d’inoculum, mais l’inoculum produit sera graduellement moins dommageable au pommier parce que moins apte à produire des symptômes.
Résistance
Recourir seulement à des cultivars résistants pour contrer la tavelure va actuellement à l’encontre de la stratégie de la diversité. Presque tous les cultivars résistants disponibles sont porteurs d’un seul gène de résistance (Rvi6)4, anciennement appelé le gène Vf (ex. : Liberty, Belmac) qui sont des descendants de Malus floribunda 821. D’autres gènes existent (ex : Rvi5 (Vm) pour Murray descendant de Malus micromalus5), mais les succès commerciaux sont rares. Or les races de tavelure locales ont déjà commencé à contourner ces gènes6. Dès qu’une souche de tavelure compatible apparaît dans un bloc avec un seul gène de résistance, elle peut rapidement occuper toute la place, ce qui revient à une spécialisation des races. Dans les blocs de pommiers Rvi6 où la résistance a été contournée, la tavelure est souvent pire que dans les blocs de cultivars conventionnels, et ce, malgré des traitements. L’utilisation simultanée de plusieurs gènes de résistance dans un même cultivar (pyramidage des gènes) fait l’objet de plusieurs travaux4 et permettrait d’atteindre la diversité requise pour atténuer la tavelure, mais de tels cultivars n’existent pas encore et l’acceptabilité sociale des cultivars multi résistants qui seraient obtenus par génie génétique n’est pas acquise. Dans les vergers où la résistance a été contournée, l’utilisation des pommetiers pollinisateurs semble être à l’origine des souches résistantes.
Mixité des cultivars
À l’inverse des blocs mono-variétaux, les blocs de pommiers entièrement mélangés ne sont pas adaptés aux opérations culturales, qui varient souvent d’un cultivar à l’autre (ex. : taille, éclaircissage), obligent à des traitements sur l’ensemble de la surface du verger et nuisent aux opérations de récolte. Même si le mélange des cultivars peut contribuer à réduire la sévérité des attaques, la mixité des cultivars ne suffit pas à maintenir la tavelure à des niveaux acceptables, et ce, même dans les blocs de pommiers où tous les pommiers seraient différents. Pour cette raison, cette pratique n’a jamais été popularisée.
Néanmoins, diminuer au minimum le nombre de rangées contiguës avec le même cultivar a pour effet d’atténuer les problèmes de tavelure7 sans nuire aux autres aspects de la production. Dans la mesure où les blocs sont optimisés pour les autres considérations agronomiques, une réduction récurrente de la tavelure qui peut atteindre 20 % n’est pas négligeable. Pour que la stratégie soit efficace, les cultivars alternés doivent être de parents éloignés et/ou de sensibilité différente à la tavelure. De plus, la largeur du bloc doit être de moins de 30 m pour permettre l’arrivée des ascospores des blocs adjacents qui pourront constamment diluer le pool génétique de la tavelure produite dans chaque bloc de cultivar. Par exemple, six rangées de 3,65 m de Spartan (McIntosh × inconnu) en alternance avec six rangées de Gala (Golden Delicious × Kidd’s Orange Red) permettrait d’atténuer la tavelure par rapport à des blocs de Spartan ou de Gala plus grands dans lesquels les spores ne se mélangeraient pas.
Réduction de l’inoculum (assainissement)
L’utilité de réduire la quantité d’ascospores qui atteignent l’arbre pour augmenter l’efficacité des traitements fongicides du printemps a été reconnue dès 1937. À l’époque, les fongicides disponibles étaient moins efficaces et les stratégies de traitement n’étaient souvent acceptables que dans les vergers où la pression de la tavelure était faible ou dans les vergers où les feuilles de la litière étaient traitées à l’automne pour détruire la tavelure en place. La réduction systématique de la pression de la tavelure par la destruction de l’inoculum dans les feuilles de la litière n’a pas connu d’essor à ce moment parce que l’arrivée graduelle de fongicides de plus en plus efficaces en a diminué le besoin. La réduction de l’efficacité des fongicides (résistance), les restrictions d’usage et l’homologation de fongicides de moindre efficacité rendent incontournable l’intégration de la gestion de la quantité de spores avant le début des traitements du printemps. La réduction de l’inoculum a un impact direct sur l’apparition des symptômes de tavelure en diminuant les probabilités d’infection, mais a également un effet indirect positif sur presque tous les aspects de la gestion de la maladie. Les mesures prises pour réduire l’inoculum en verger peuvent aider à compenser pour les erreurs de traitement, diminuent la sélection des spores résistantes aux fongicides, facilitent l’utilisation de produits de moindre efficacité et réduisent la nécessité des traitements d’été.
Dans les vergers où l’incidence de la tavelure est en apparence faible, les stratégies d’assainissement n’ont pas toujours d’impact mesurable ou rentable dans la gestion de la tavelure. Par contre, comme la tavelure peut progresser discrètement à l’automne ( la section sur la tavelure d’automne dans la fiche sur La tavelure : biologie) et que les conditions hivernales peuvent amplifier la production d’inoculum même dans les vergers peu tavelés (voir la section sur la production de l’inoculum primaire, dans la fiche sur La tavelure : biologie) les mesures d’assainissement sont recommandées à titre préventif comme une habitude à intégrer, même si le bénéfice immédiat n’est pas perceptible.
Différentes approches sont possibles pour réduire le nombre de spores qui atteignent l’arbre. Certaines techniques peuvent être indifféremment utilisées à l’automne ou au printemps, mais certaines ne sont possibles qu’à un moment précis. Comme la chute des feuilles est souvent très étalée et n’est complétée souvent qu’à la fin novembre ou même plus tard, les techniques qui requièrent d’atteindre toutes les feuilles au sol ne sont habituellement pas praticables au Québec en automne. De même, les traitements sur l’arbre sont possibles seulement entre le 15 octobre et le 1er novembre environ, soit après la récolte et avant le remisage des équipements pour l’hiver. Il est possible d’accélérer la chute des feuilles, mais cette pratique fréquente chez les pépiniéristes n’est pas usuelle dans les vergers commerciaux.
La fenêtre d’intervention privilégiée pour interférer avec l’inoculum est donc au printemps, après la fonte des neiges mais avant le débourrement. Comme les éjections à risque peuvent parfois commencer dès le stade débourrement, les interventions les plus hâtives sont les plus rentables. Une seule stratégie (épuisement) est conçue pour être utilisée pendant la saison des éjections, mais cette technique inusitée n’est pas en usage.
Les approches visent un ou plusieurs objectifs à la fois : affecter directement le champignon pour limiter la production des spores, provoquer une décomposition de la litière où réside le champignon et finalement, interférer directement avec l’éjection des spores au printemps. La liste des stratégies présentée ici n’est pas exhaustive mais donne un bon aperçu des possibilités. Les méthodes décrites peuvent être combinées pour augmenter leur efficacité. Des mesures non spécifiques qui favorisent indirectement la réduction de l’inoculum, tel qu’éviter les fongicides comme qui nuisent aux populations de vers de terre, sont couvertes ailleurs. Certaines approches ont également des conséquences néfastes qu’il importe de souligner. Le tableau qui suit présente un aperçu des méthodes décrites en détail par la suite.
| STRATÉGIES DE RÉDUCTION D’INOCULUM (EN ORDRE DÉCROISSANT D’INTÉRÊT EN PFI) | MISE EN PLACE | PROBLÈMES ENGENDRÉS OU LIMITES |
| Urée | Automne/printemps | Favorise les chancres à l’automne. Urée à considérer dans la gestion de l’azote. |
| Déchiquetage | Automne/printemps | |
| Balayage/soufflage | Automne/printemps | |
| Élimination des pommiers sauvages ou abandonnés | Printemps | Portée limitée |
| Ramassage des feuilles | Automne/printemps | Gestion des résidus |
| Chaulage | Automne | |
| Rebouche ornières | Printemps | |
| Labour | Automne/printemps | Abîme le terrain |
| Paillage/couvre-sols | Printemps | Pas au point |
| Épuisement des éjections | Printemps | Source d’eau disponible |
| Autres traitements | Automne/printemps | Problèmes variés |
Urée
Très peu d’articles portant sur la tavelure du pommier ont eu le privilège d’avoir été publiés par la prestigieuse revue scientifique Nature8. Le plus connu traite de l’efficacité de l’urée pour lutter contre la maladie. L’article a été publié en 1965 et depuis lors, les travaux sur l’urée et la tavelure se sont multipliés. L’engouement des scientifiques ne s’est pas transposé dans les vergers et encore peu de producteurs intègrent l’urée dans leur arsenal contre la tavelure.
L’urée n’est pas perçue comme un fongicide très efficace, mais a un mode d’action complexe qui garantit que l’un ou l’autre de ses mécanismes sera actif et que le champignon ne pourra pas devenir résistant. D’abord, l’urée s’attaque directement au champignon et interfère avec la production des pseudothèces. De plus, l’urée stimule l’activité microbienne qui dégrade les feuilles au sol et rend celles-ci plus appétissantes pour les vers de terre. Différentes études ont porté sur les alternatives à l’urée pour combattre la tavelure, incluant d’autres formes d’azote. Les études montrent que l’azote sous forme ammoniacale a une certaine efficacité à l’automne quand le pH est bas (ex. : sulfate d’ammonium), mais pas les nitrates.
La stratégie d’application de l’urée est flexible. Le traitement peut être fait à l’automne ou au printemps. Malheureusement, l’urée de source industrielle n’est pas admise en production biologique mais si une source est disponible (ex : élevage à proximité), cette approche est envisageable.
Fait peu connu, l’urée n’est pas seulement efficace sur les feuilles mortes. Des applications foliaires d’urée sont aussi possibles pendant la saison des infections primaires9 (voir la fiche sur La tavelure : traitements contre les infections primaires).
Traitement foliaire ou de litière : Le traitement d’urée peut être appliqué directement sur l’arbre avant la chute des feuilles à l’automne, ce qui assure une meilleure couverture10 que lorsque le traitement est appliqué au sol. Cet apport d’azote automnal n’a pas de conséquences graves sur l’arbre et peut même être bénéfique. Cependant, l’apport nutritionnel sera négligeable si les feuilles contiennent déjà beaucoup d’azote11. Par ailleurs, un apport d’urée automnal sur des jeunes arbres pas encore productifs pourrait être néfaste10 et dépasser 50 kg/ha à l’automne peut mener à une mortalité partielle des bourgeons12. Finalement, les applications d’urée à l’automne sont associées à une augmentation des problèmes de chancre européen13 et il n’est pas exclu que l’urée qui atteint le bois au printemps puisse aussi causer des problèmes en facilitant l’infection de Nectria sp. au niveau des blessures de taille d’hiver.
Quand l’application d’automne a lieu trop longtemps avant la chute des feuilles, l’urée est métabolisée et son action contre la tavelure est moindre. L’urée foliaire à l’automne appliquée sur du feuillage encore fonctionnel est absorbée par l’arbre en 48 heures14 et n’a alors pas d’effet sur la tavelure. Pour maximiser l’effet contre la tavelure il faut donc retarder autant que possible le traitement après la sénescence des feuilles et/ou accélérer la défoliation (voir la section Accélération de la chute des feuilles plus loin dans cette fiche). Le traitement au sol doit être fait après la chute des feuilles et est donc souvent retardé au printemps, avant le stade du débourrement, ou le plus tôt possible après le débourrement. À mesure que les spores arrivent à maturité, l’effet de l’urée est amoindri et cet azote appliqué au sol peut mener à des effets néfastes au moment où il deviendra disponible à l’arbre (voir la fiche sur La fertilisation sans nuire à la phytoprotection).
Recette : Appliquez 50 kg d’urée par hectare dans un volume suffisant pour dissoudre l’urée. Les américains préconisent près de 1000 litres d’eau par hectare (40 lbs d’urée dans 100 gallons par acre15), mais il n’est pas nécessaire d’utiliser un volume aussi élevé. En fait, les résultats sont probablement meilleurs quand l’urée est appliquée dans un volume plus faible de bouillie10. Le volume minimal requis pour dissoudre 50 kg d’urée est 75 L d’eau à 0 °C16, mais c’est plus facile avec les volumes usuels (ex : 250 L/ha). Il n’y a donc pas de problème de préparation, même par temps froid. L’efficacité est proportionnelle à la quantité d’urée appliquée et donc diminuer la quantité d’urée par hectare diminue l’efficacité17. L’ajout d’une petite quantité de LI700 en mélange avec l’urée augmente son effet18
Pour les traitements au sol, vous pouvez l’appliquer avec votre pulvérisateur conventionnel de deux manières : soit en utilisant seulement les jets du bas, ou mieux encore en branchant une simple rampe horizontale (style herbicide) avec des buses qui couvrent au mieux la largeur de la rangée. Il est également possible d’utiliser votre pulvérisateur d’herbicide conventionnel et de le modifier pour couvrir plus large. Cette dernière solution est moins intéressante à cause des volumes d’eau importants à transporter. L’objectif est de bien mouiller la zone où on trouve les feuilles de litière, souvent le long du rang. Il est aussi préférable d’éviter d’atteindre le bois dans les vergers avec des problèmes de chancres. Utilisez 200-400 L/ha au maximum pour éviter le ruissellement. L’urée après le déchiquetage donne les meilleurs résultats. Évitez d’appliquer l’urée juste avant une pluie. Comme l’urée est très soluble, elle serait alors rapidement éliminée par ruissellement. Cependant, le temps de contact requis entre l’urée et les feuilles de litière pour maximiser l’efficacité n’a pas été étudié spécifiquement. L’urée appliquée à la volée en granules n’est pas absorbée également par la litière et n’est donc pas aussi efficace.
L’urée de grade « foliaire » a une faible teneur en « biuret », un composé azoté phytotoxique. Ce grade de qualité n’est évidemment pas nécessaire pour des traitements au sol, mais c’est ce qui est proposé pour éviter de confondre les deux grades et abîmer le feuillage lors des traitements d’engrais à base d’urée foliaire.
Fertilisation en prime : Les apports d’urée pour réprimer la tavelure doivent être comptabilisés. L’apport de 50 kg d’urée (46 % N) représente 23 kg d’azote par hectare. Cet apport est modeste, mais il faut en tenir compte avant d’intégrer cette approche à vos pratiques. Pour plus d’informations, consultez la fiche sur La fertilisation sans nuire à la phytoprotection.
Déchiquetage
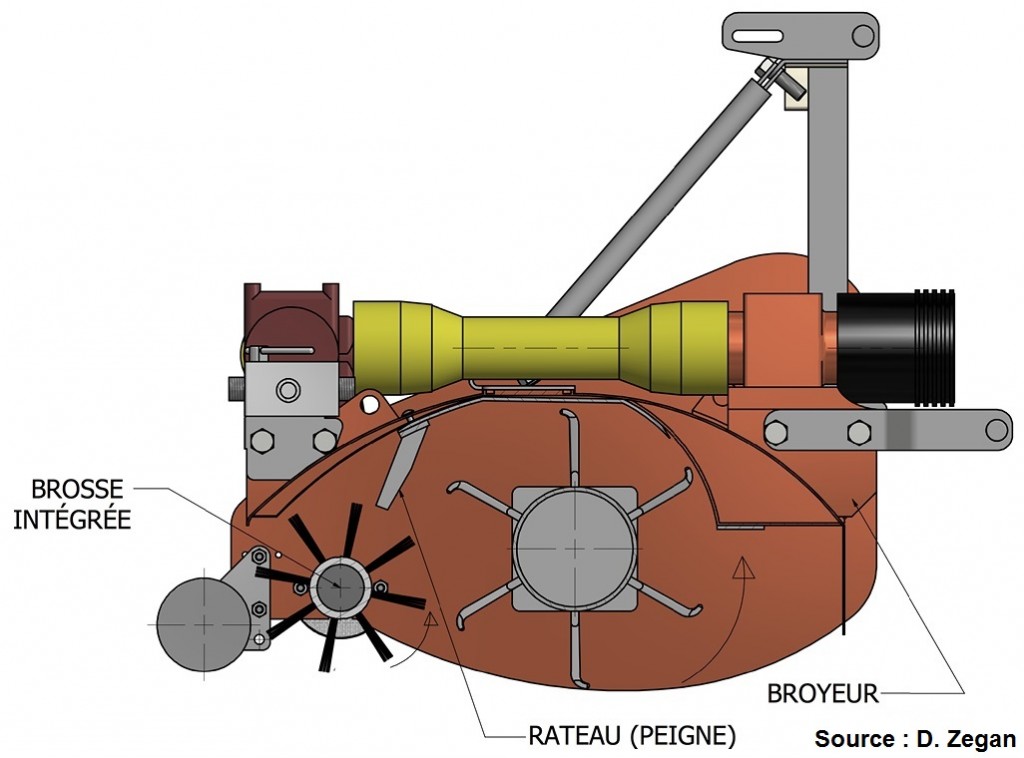
L’objectif du déchiquetage est de détruire mécaniquement les feuilles et de les laisser au sol. Même si le déchiquetage n’attaque pas directement le champignon, la réduction de la taille des fragments foliaires accélère grandement leur décomposition. De plus, inverser l’orientation des fragments de feuilles au sol peut nuire à l’éjection des ascospores. Pour plus d’informations, la vidéo Le broyeur de feuilles présente le broyeur de feuilles EliminaeMD qui a été développé au Québec sous la collaboration de l’IRDA (Vincent Philion) et le témoignage de Francis Brabant du .
Selon l’équipement disponible, cette opération peut être assez facile et peu coûteuse. Par exemple, l’utilisation d’une faucheuse à fléaux ou d’un broyeur à marteaux permet aussi d’éliminer une partie de la litière. Il faut régler l’appareil assez bas pour bien rejoindre les feuilles collées au sol et les déchiqueter. Une faucheuse rotative ne permet pas cette opération10.
Broyeur à marteaux (source : Vincent Philion).
Idéalement, toute la surface du verger doit être travaillée mécaniquement en déportant l’appareil le plus près possible des rangées d’arbres.
Quand l’opération est faite au printemps, il est possible de déchiqueter le bois de la taille hivernale et de réduire l’inoculum de la tavelure simultanément. Il est même possible que cette opération combinée permette de réprimer d’autres maladies, comme la pourriture noire, le chancre européen et le feu bactérien qui sont présents sur le bois de taille. Par contre, cette opération ne doit pas être réalisée dans les sites où le sol laissé à nu risque de créer des conditions boueuses pour les passages subséquents des équipements.
Balayage/soufflage
Le balayage des feuilles avec des brosses rotatives ou des souffleries puissantes peut être utilisé pour mieux décoller les feuilles du sol, incluant celles qui sont inaccessibles par le déchiquetage, et les andainer dans le centre des rangées où elles pourront être fauchées ou déchiquetées. Cette stratégie est notamment très utile dans les vergers de pommiers nains, puisque les feuilles de litière s’accumulent sur la bande désherbée. Comme pour le déchiquetage, le simple déplacement des fragments de feuilles au sol peut aussi nuire à l’éjection des ascospores.
Soufflerie montée sur tracteur (source : Vincent Philion).
Passage de la brosse rotative (gauche) et sol après passage de la brosse rotative (droite)(source : Vincent Philion).
Le balayage/soufflage peut être fait séparément du déchiquetage ou avec un appareil combiné. L’intégration d’une brosse horizontale à un broyeur conventionnel améliore à faible coût l’efficacité des broyeurs conventionnels. L’appareil modifié en ce sens, baptisé Eliminae, peut être fabriqué directement par les producteurs à partir de plans publics ou sur commande. Un document d’accompagnement pour la modification des broyeurs est disponible en ligne.19
Schéma d’un appareil de broyage et découpage combiné (source : IRDA et Agrinova).
Élimination des pommiers sauvages ou abandonnés
Les pommiers en bordure des vergers peuvent constituer une source non négligeable d’inoculum de tavelure et d’autres ravageurs du pommier. L’élimination des arbres dans un périmètre de 50 m autour du verger devrait suffire à éliminer la plupart des sources d’ascospores extérieures au verger. Les pommiers abandonnés des propriétés voisines peuvent faire l’objet d’une plainte en vertu de la Loi sur la protection sanitaire des cultures si la situation ne peut être réglée à l’amiable (voir la fiche sur le Le « droit de produire » et la Loi).
Ramassage des feuilles
Le ramassage des feuilles a pour but d’interférer avec les éjections en verger en retirant la source de contamination du verger pour en disposer dans un site éloigné. La méthode est jugée plus efficace que le seul déchiquetage pour réduire l’inoculum. Même si le volume de feuilles à déplacer n’est pas très important et peut être comprimé, cette approche entraîne un problème de gestion des résidus ramassés. Soit les résidus sont enlevés de façon permanente, ce qui réduit la matière organique des vergers, soit les résidus sont retournés au verger après la période des risques (ou après compostage), ce qui entraîne des coûts additionnels. De plus, un des appareils disponibles, le Combi-Trailer (photo suivante), utilisé en Europe pour le broyage et le ramassage des feuilles de litière a été brièvement testé au Québec et ne s’est pas avéré assez robuste pour broyer le bois de taille hivernal. Pour ces raisons, le ramassage n’est pas recommandé en PFI.
Combi-Trailer (source : Vincent Philion).
Chaulage
Le chaulage d’automne, réalisé dans le but d’augmenter le pH du sol, inhibe aussi partiellement la formation des pseudothèces et peut être une alternative à l’urée, quoique moins efficace. Le chaulage au printemps est possible, mais la contribution à la réduction de l’inoculum est encore moindre. L’incorporation (enfouissement) de la chaux préconisée pour les apports élevés (> 4 tonnes /ha) pourrait aussi contribuer à éliminer une partie de la litière de surface. Cependant, même un apport élevé de chaux ne peut pas être considéré comme un substitut équivalent aux autres méthodes de réduction de l’inoculum. À raison de 40 $/tonne, la réduction de l’inoculum obtenue par le chaulage ne justifie pas à elle seule le coût de l’opération par rapport à d’autres approches.
Accélération de la chute des feuilles
Le cuivre chélaté (EDTA de cuivre) vendu comme engrais soluble est fréquemment utilisé par les pépiniéristes pour accélérer la chute des feuilles. En production commerciale, cette pratique pourrait augmenter l’efficacité de l’urée foliaire à l’automne, faciliter l’élimination des feuilles de la litière et réduire les infections foliaires de chancre européen à l’automne13. Un seul traitement de 14 L/ha (chélaté à 14-15 %, soit 2 kg/ha de cuivre métal) appliqué immédiatement après la récolte est efficace, mais le fractionnement en 2 applications de 7 L/ha espacées d’une semaine est encore mieux (Fanny Le Berre, comm. Pers). Une dose plus élevée (20 L/ha) a été testée avec succès à l’IRDA.
Épuisement des éjections
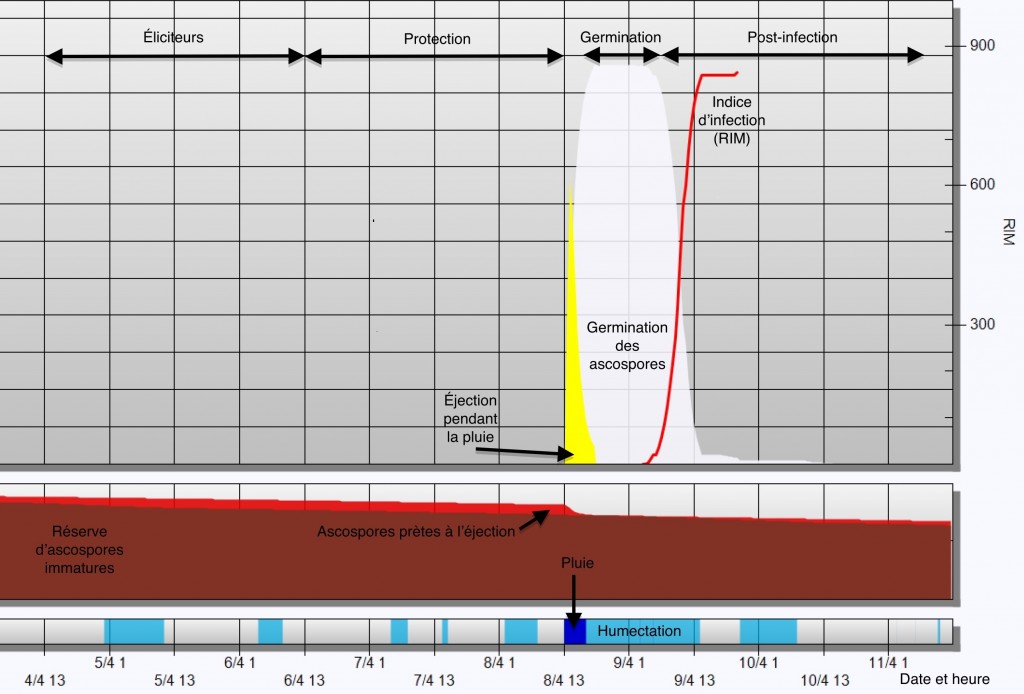
La technique de l’épuisement des éjections vise à profiter de périodes sèches au printemps pour accélérer la maturation et l’éjection des spores en dehors des épisodes de pluie. Un système d’irrigation par aspersion est utilisé pour mouiller la litière, sans pour autant permettre la germination et l’infection des spores. Les gicleurs peuvent être installés près du sol et dans ce cas les arbres demeurent secs, mais les gicleurs installés au-dessus des arbres comme protection du gel peuvent également être utilisés en limitant le temps de mouillage20. L’objectif de l’épuisement est de diminuer le nombre d’ascospores éjectées durant les pluies d’infection. Une heure ou deux d’irrigation à tous les deux ou trois jours pendant les périodes sèches suffisent, en théorie, à épuiser le potentiel d’éjection des spores et à réduire les risques d’infection lors des pluies. En pratique, l’application de 2 mm/heure entre 11h00 et 13h00 les jours ensoleillés pendant la période des infections primaires, soit 5 à 11 jours d’irrigation au total par année a considérablement réduit l’éjection des spores pendant les périodes de pluie, accéléré la fin de la période des infections primaires et provoqué une réduction de 50 % de la tavelure observée20.
La méthode est efficace tant que l’irrigation est synchronisée plusieurs jours après la dernière pluie pour permettre la maturation des spores et au moins 24h avant la pluie suivante pour éviter que les ascospores éjectées pendant l’irrigation puissent survivre et infecter les arbres plus tard. En limitant le temps d’humectation des arbres, en principe les gicleurs au sol sont moins à risque de provoquer des infections accidentelles même si les spores éjectées atteignent les feuilles21. En pratique, le séchage des arbres suivant l’irrigation en plein jour est rapide et le temps d’humectation suivant l’irrigation n’est pas un facteur de risque majeur.
L’épuisement des spores est réaliste les années plus sèches lorsque les pluies sont assez espacées pour la mettre en place. Lorsque les pluies sont fréquentes, l’irrigation, même bien ciblée, ne permet pas l’éjection d’un nombre élevé de spores et peut accroître les risques d’infection, soit en prolongeant une infection passée ou par la survie des spores éjectées lors des pluies suivant l’irrigation. La technique de l’épuisement des éjections est utilisée dans certains vergers en Europe, mais est de portée limitée. Les risques associés à la fiabilité des prévisions météorologiques d’accroître l’infection en cas d’utilisation trop près d’une pluie et la disponibilité limitée de l’eau pour l’irrigation font en sorte que cette stratégie n’est pas actuellement recommandée en PFI.
Rebouche ornière
Les passages fréquents du tracteur compactent le sol et forment des ornières dans les rangées. Si la réparation des ornières est faite tôt au printemps, cette opération peut contribuer à ensevelir les feuilles de la litière et accélérer leur dégradation.
Labour
L’incorporation dans le sol des feuilles de la litière par un labour superficiel est pratiquée dans certains pays pour favoriser la décomposition des feuilles et interférer avec les éjections au printemps. Cette pratique n’est pas envisageable dans les vergers pierreux et peut nuire au passage des équipements en créant des conditions boueuses. Conséquemment, cette stratégie n’est pas recommandée en PFI.
Paillage et couvre-sols
Certains chercheurs ont imaginé qu’il pourrait être possible d’intercepter les spores au moment de l’éjection avec des paillis naturels ou artificiels installés par-dessus la litière avant les éjections au printemps. De même, des plantes couvre-sol à croissance rapide qui couvriraient les feuilles de la litière avant la période des éjections ont également été testées mais ne sont pas prometteuses22. Ces approches ne sont pas au point et ne sont donc pas actuellement recommandées en PFI.
Autres traitements pendant la saison morte
Certains traitements fongicides d’automne appliqués directement sur l’arbre après la récolte ou au sol sur la litière peuvent pénétrer les feuilles et interférer directement avec la survie du champignon. Les traitements de litière au printemps avec différents produits sont aussi rapportés23. Ces stratégies sont parmi les plus anciennes répertoriées. Or les fongicides utilisables à l’époque étaient très toxiques ou avaient des effets adverses sur la faune auxiliaire et seraient aujourd’hui inadmissibles en PFI. Les fongicides disponibles actuellement qui sont efficaces pour cet usage24 sont pour la plupart sujets à la résistance. Le Captan24 serait efficace et non sujet à la résistance, mais les restrictions d’usage limitent l’utilité de cette option. Au global, la stratégie d’utiliser des fongicides après la récolte n’est pas reconnue utile en PFI. D’autres substances, incluant des herbicides10 ont un effet reconnu pour la réduction de l’inoculum mais ces pratiques ne sont pas homologuées.
Des antagonistes microbiens ont aussi été suggérés comme stratégie de lutte biologique à l’automne pour réprimer la production d’inoculum25. Malheureusement, aucun projet n’a abouti à un produit homologué. Les antagonistes sont souvent efficaces au laboratoire, mais perdent leur efficacité en verger26. Néanmoins, certains projets sont toujours actifs et pourraient mener à des solutions viables au cours des prochaines années. Par exemple, des extraits de levures de brassage appliqués à la litière ont un effet inhibiteur reconnu sur la tavelure27 et leur application augmente indirectement l’activité des vers de terre. D’autres produits à forte teneur en acides aminés (caséine dégradée) ont le même effet28.
Comme ces extraits sont parfois des déchets de l’industrie alimentaire (ex : production brassicole) et certifiables en production biologique28, leur disponibilité à bon marché pourrait être utile à l’industrie pomicole.
Finalement, l’utilisation de brûleurs au propane, d’appareils générateurs de vapeur, ou d’eau chaude a été proposée pour détruire l’inoculum à l’automne ou au printemps. Aucune de ces solutions n’a connu de suite et n’est utilisée.
Gestion de la croissance estivale
Les infections secondaires sur feuillage ont surtout lieu sur les pousses en croissance et parfois en fin de saison sur les feuilles qui ont perdu leur résistance naturelle (voir la fiche sur La tavelure : biologie). Toutes les interventions visant à diminuer la quantité de feuillage sensible ont donc un impact direct sur la propagation de la tavelure en été et indirectement sur l’infection des fruits. Réduire la croissance et un programme de taille estivale sont donc des éléments importants pour la gestion de la tavelure.
Réduction de la vigueur
Dans les limites de ce qui est acceptable d’un point de vue horticole, toutes les interventions favorisant une fin de croissance plus hâtive diminuent la vitesse de propagation en été. En Allemagne, la fin des programmes visant à garder les arbres jusqu’après la récolte ont eu un sur les besoins de traitements fongicides en été. Ainsi, la fertilisation, le contrôle de charge et les hormones de croissance peuvent jouer un rôle. Par exemple, les traitements à l’Apogee (voir la fiche sur La tavelure : traitements d’été), la taille des racines et des coupes dans le phloème, aussi connue comme «scoring», sont à considérer.
Taille estivale
La taille permet d’aérer les arbres, et donc accélère le séchage des feuilles. Comme la durée d’humectation est un facteur aggravant (voir infection), toute mesure qui réduit le temps de séchage aura un impact sur la propagation de la tavelure et l’incidence de la tavelure sur fruits. Par contre, l’effet de la taille est beaucoup moins prononcé sur les infections primaires parce que la quantité de feuillage à cette période n’est habituellement pas suffisante pour influencer de façon notable la durée de séchage, même dans les vergers mal entretenus. La taille a donc peu d’effet sur l’apparition des symptômes d’infection primaire. De même, comme la tavelure primaire n’est pas diminuée par la taille, la production d’inoculum à l’automne suivant n’est pas affectée. Néanmoins, la taille d’été a un impact sur l’apparition d’autres maladies estivales, comme le complexe suie–moucheture, et est donc une mesure utile pour la gestion des maladies. Un bon émondage facilite aussi la pénétration de la bouillie fongicide pendant les pulvérisations.
Références
- Provancher, L. Le verger canadien, ou, Culture raisonnée des fruits qui peuvent réussir dans les vergers et les jardins du Canada. (1862).
- MacHardy, W.E., Gadoury, D.M. & Gessler, Parasitic and biological fitness of Venturia inaequalis: relationship to disease management strategies. Plant Dis. 85:1036‑1051. (2001).
- Clark, M.D., Bus, V.G., Luby, J.J. & Bradeen, J. Characterization of the defence response to Venturia inaequalis in ‘Honeycrisp’apple, its ancestors, and progeny. Eur. J. Plant Pathol. 1‑13. (2014).
- Patocchi, A., Wehrli, A., Dubuis, P-H., et al. Ten years of VINQUEST: first insight for breeding new apple cultivars with durable apple scab resistance. Plant Dis. Sci. Soc. 104:2074‑ (2020).
- Parisi, L. & Lespinasse, Pathogenicity of Venturia inaequalis strains of race 6 on apple clones (Malus sp.). Plant Dis. 80:1179‑1183. (1996).
- Papp, D., Singh, J., Gadoury, D. & Khan, New North American isolates of Venturia inaequalis can overcome apple scab resistance of Malus floribunda 821. Plant Dis. Am. Phyto. Soc. 104:649‑655. (2020).
- Stewart, K., Passey, T., Verheecke-Vaessen, C., et al. Is it feasible to use mixed orchards to manage apple scab? Fruit Res. (2023).
- Burchill, R.T., Hutton, K.E., Crosse, J.E. & Garrett, C.M. Inhibition of perfect stage of Venturia inaequalis (Cooke) Wint., by Urea. Nature. 205:520‑521. (1965).
- Stoddard, E. Fungicidal synergism between urea and sulfur. Phytopath. 40:27. (1950).
- Rosenberger, A stitch in time …? Fall treatments for reducing scab inoculum for 1997. Scaff. fruits J. 5. (1996).
- Cheng, L., Dong, S. & Fuchigami, L. Urea uptake and nitrogen mobilization by apple leaves in relation to tree nitrogen status in autumn. J. Hortic. Sci. Biotechnol. 77:13‑18. (2002).
- Wood, P.N. & Beresford, R. Avoiding apple bud damage from autumn-applied urea for black spot (Venturia inaequalis) control. Proc. N.Z. Plant Prot. Conf. 382‑386. (2000).
- Dryden, G.H., Nelson, M.A., Smith, J.T. & Walter, Postharvest foliar nitrogen applications increase Neonectria ditissima leaf scar infection in apple trees. N. Z. Plant Prot. 69:230‑237. (2016).
- Dong, S., Cheng, L., Scagel, C.F. & Fuchigami, L. Nitrogen absorption, translocation and distribution from urea applied in autumn to leaves of young potted apple (Malus domestica) trees. Tree Physiol. 22:1305‑10. (2002).
- Sutton, D.K., MacHardy, W.E. & Lord, W. Effects of shredding or treating apple leaf litter with urea on ascospore dose of Venturia inaequalis and disease buildup. Plant Dis. 84:1319‑1326. (2000).
- Urée. Wikipédia. (2018).
- Beresford, R.M., Horner, I.J., Wood, P.N. & Zydenbos, S. Autumn-applied urea and other compounds to suppress Venturia inaequalis ascospore production. Proc. N.Z. Plant Prot. Conf. 387‑392. (2000).
- Beckerman, J. & Abbott, Comparative Studies on the Effect of Adjuvants with Urea to Reduce the Overwintering Inoculum of Venturia inaequalis. Plant Dis. Am. Phytopath. Soc. 103:531‑537. (2019).
- Guide pour le montage et l’utilisation du broyeur de litière EliminaeTM. (2013).
- Prodorutti, D., Bugiani, R., Philion, V., et al. Irrigation Targeted to Provoke Ejection of Ascospores of Venturia inaequalis Shortens the Season for Ascospore Release and Results in Less Apple Scab. Plant Dis. Sci. Soc.108:1353‑13 (2024).
- Prodorutti, D., Vendrame, N., Coller, E., et al. Aerial dispersal of Venturia inaequalis ascospores with under-canopy sprinkler irrigation for apple scab management. Eur. J. Plant Pathol. (2024).
- Aylor, D. The aerobiology of apple scab. Plant Dis. 82:838‑849. (1998).
- Curtis, K. Black-spot of apple and pear: experiments in possible methods of reducing infection. N. Z. J. Agric. 21‑28. (1924).
- Wood, P.N., Beresford, R.M. & Taylor, T. Suppression of Venturia inaequalis (apple scab) ascospore production using autumn-applied fungicides. N. Z. Plant Prot. 61:54‑58. (2008).
- Young, C.S. & Andrews, J. Inhibition of pseudothecial development of Venturia inaequalis by the basidiomycete Athelia bombacina in apple leaf litter. Phytopath. 80:536‑542. (1990).
- Stadler, M. & Tiedemann, Biocontrol potential of Microsphaeropsis ochracea on microsclerotia of Verticillium longisporum in environments differing in microbial complexity. BioControl. 59:449‑460. (2014).
- Pfeiffer, B., Alt, S., Häfner, C., Hein, B., Schulz, C. & Kollar, A. Investigations on alternative substances for control of apple scab-results from sanitation trials. Ecofruit In Weinsberg, Germany. 79‑84. (2004).
- Porsche, F.M., Pfeiffer, B. & Kollar, A new phytosanitary method to reduce the ascospore potential of Venturia inaequalis. Plant Dis. 101:414‑420. (2017).
Cette fiche est une mise à jour de la fiche originale du Guide de référence en production fruitière intégrée à l’intention des producteurs de pommes du Québec 2015. © Institut de recherche et de développement en agroenvironnement. Reproduction interdite sans autorisation.