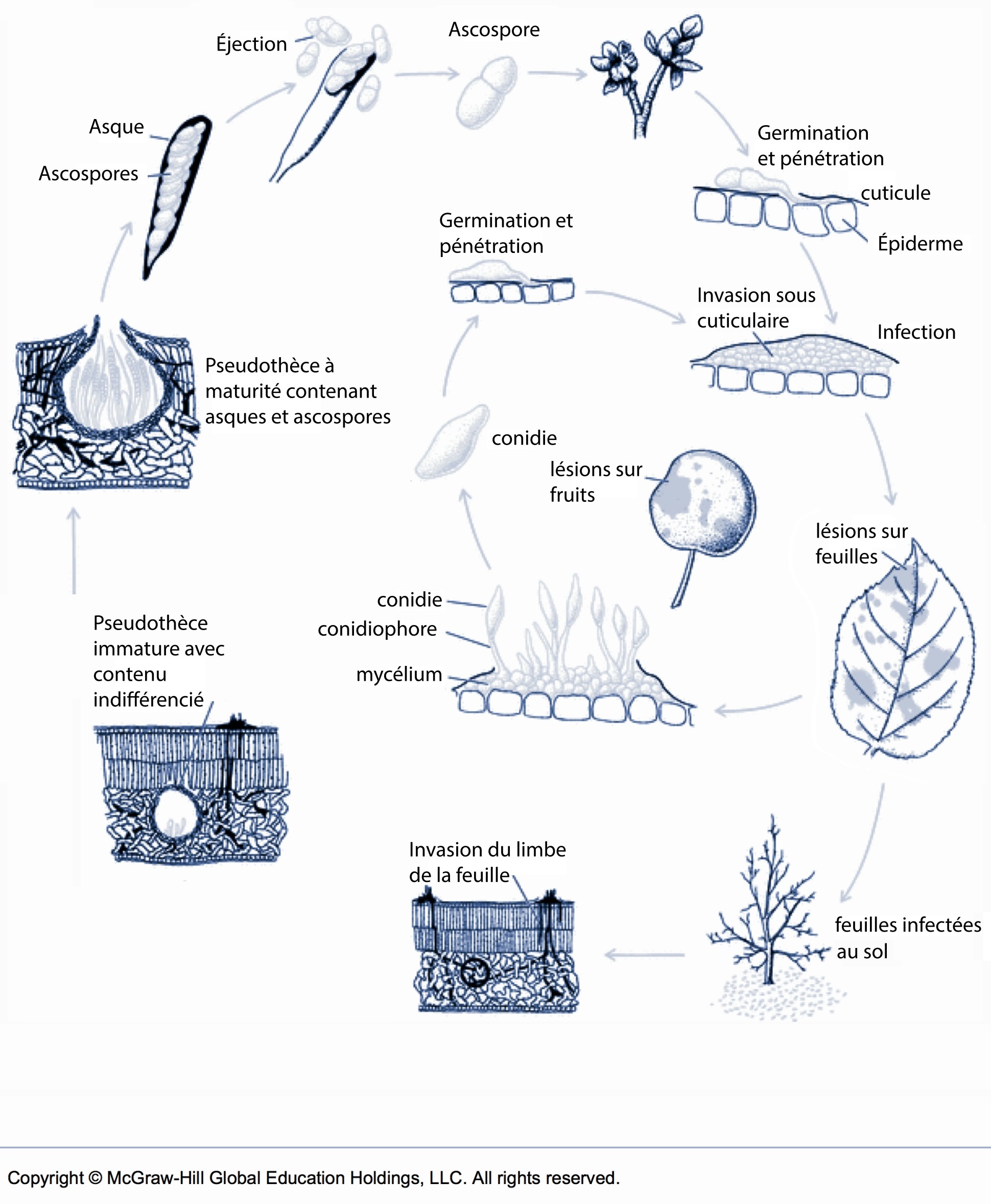
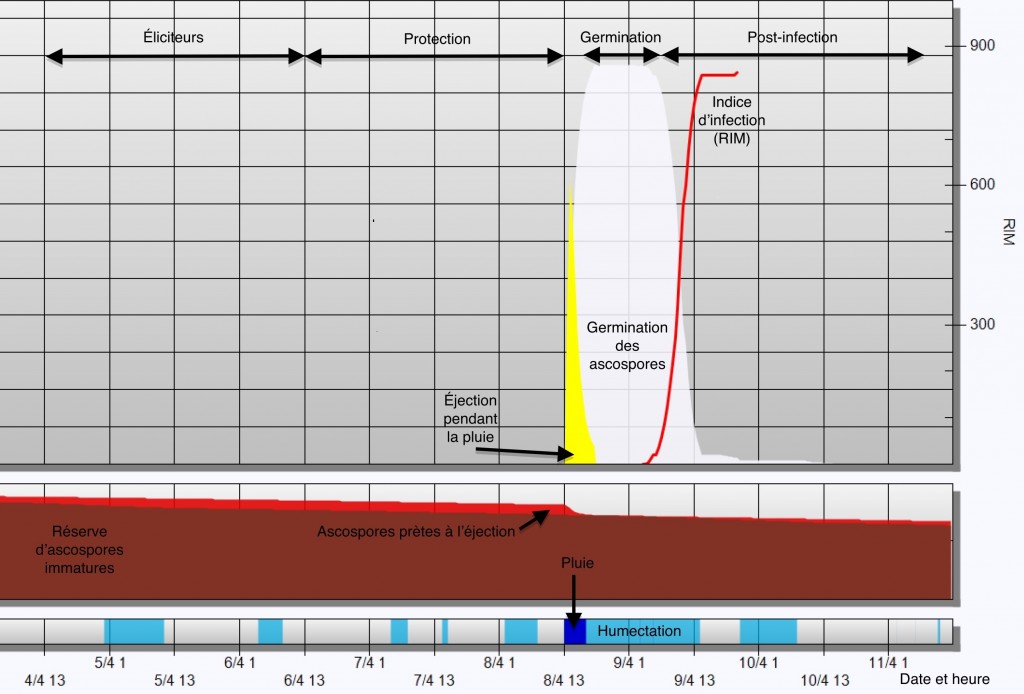
Fiche 106
Vincent Philion
Cet ennemi du pommier est réglementé en vertu de la Loi sur la protection sanitaire des cultures (Fiche 15) et les mesures nécessaires doivent être prises pour éviter la propagation aux cultures avoisinantes.
Voyez le feu bactérien sur YouTube à https://www.youtube.com/watch?v=4kk7HjBtLkc!
La capsule vidéo de 8 minutes dresse un portrait du ravageur, montre ses caractères distinctifs, identifie les conditions qui influencent son développement, et vous plonge dans l’action du dépistage et des méthodes d’intervention recommandées en production fruitière intégrée. |
Les changements importants dans l’architecture des vergers, le choix des cultivars et le climat au cours des dernières décennies ont eu pour effet d’augmenter considérablement les risques de feu bactérien. Conséquemment, les stratégies d’intervention ont beaucoup évolué pour faire face à cette nouvelle réalité. En outre, les pratiques valables à l’époque des pommiers de type standard et des cultivars tolérants ne sont pas adaptées aux pommiers à plus haute densité et aux cultivars plus sensibles. L’intensité des mesures qui sont nécessaires pour réprimer le feu doit s’adapter à chaque bloc de verger.
La gestion du risque du feu bactérien débute par un choix éclairé des cultivars et des porte-greffes lors de la plantation et par l’élimination annuelle de toutes les sources d’infection connues. Quand les conditions climatiques sont favorables au feu, les différentes stratégies de traitement doivent être adaptées à l’historique de feu du secteur, au cultivar et à l’âge des arbres. Simplement s’en remettre aux traitements antibiotiques durant la floraison expose au risque d’avoir de mauvaises conditions d’application, une erreur de synchronisation avec les conditions d’infection et une éventuelle résistance des bactéries au produit utilisé. À l’inverse, ignorer les indices de risque de cette maladie expose à la possibilité d’une épidémie majeure qui peut détruire un verger en une saison.
Nouveaux vergers
Choix des porte-greffes
L’établissement de vergers à haute densité implique nécessairement des branches latérales courtes et une croissance rapide pour assurer un retour sur l’investissement. Or ces deux éléments sont également des facteurs clefs pour l’invasion des racines par le feu bactérien et la mort de l’arbre. À défaut de choisir un mode de production plus extensif et des arbres de type semi-nains (ex. : MM106, MM111, M7) et/ou une croissance lente, la première ligne de défense est de choisir pour ses nouvelles plantations des porte-greffes résistants ou tolérants face à cette maladie. Les porte-greffes comme Budagovsky 9 & 10 (B9, Bud-9 et B9, Bud-10) et les porte-greffes de la série Geneva (ex. : G.41, G.935, G.30) n’empêchent pas la maladie d’attaquer les arbres, mais ils éliminent la phase la plus destructrice de la maladie, soit la mortalité liée à l’infection du porte-greffe. La probabilité de sauver un arbre en éliminant les parties affectées est beaucoup plus élevée quand le porte-greffe est tolérant à la maladie.
Tous les autres porte-greffes nanisants incluant les séries Malling (M9, M26, etc.), incluant toutes leurs variations (ex. : M9 Cepiland, Lancep, NAKB, Pajam, etc.), et Ottawa (O.3, O.8) sont très sensibles au feu bactérien et augmentent les risques. Même si le choix des porte-greffes ne repose pas seulement sur la sensibilité aux maladies, les risques croissants de feu bactérien doivent être pris en considération. Choisir un porte-greffe résistant peut compenser en partie le choix d’un cultivar sensible.
Choix des cultivars
En pomiculture, le choix du cultivar est rarement réalisé en fonction de la sensibilité aux maladies. Néanmoins, selon la sensibilité du marché visé par rapport à l’utilisation des antibiotiques, il peut être utile de réduire les risques de feu bactérien en choisissant un cultivar tolérant de concert avec un porte-greffe résistant. Par contre, les cultivars les moins sensibles au feu bactérien (ex. : McIntosh) ont souvent une valeur économique moindre que les cultivars les plus sensibles (ex. : Gala). Le tableau suivant propose une classification des principaux cultivars et porte-greffes de pommier en fonction de leur sensibilité à la brûlure bactérienne.
Il existe cependant des cultivars de poiriers très tolérants à la maladie (ex. : cultivars de la série Harrow). Pour d’autres fruits qui ne sont pas commercialisés par cultivar (ex. : coing1), la sélection de cultivars résistants est une avenue intéressante.
| Sensibilité |
Cultivars |
Porte-greffes |
| Très sensibles |
Idared, Paulared, Jersey Mac, Rome Beauty, Gala, Golden Russet, Lodi, Cortland, GingerGold, JonaGold, Mutsu, Wealthy |
M26, MM106 |
| Sensibles |
Golden Delicious, Honeycrisp*, Spartan, Lobo, Northern Spy |
|
| Peu sensibles |
Délicieuse, Empire, Liberty, McIntosh, McFree |
MM111 |
| Tolérants ou résistants |
|
B.9, M7, série Geneva |
*Les fleurs de Honeycrisp comme celles de tous les cultivars sont sensibles au feu mais comme la floraison de Honeycrisp est hâtive et que le bois est assez tolérant, cette variété est souvent moins affectée.
Même si la propagation bactérienne est favorisée par la succession florale dans le temps et que la température a tendance à augmenter entre la floraison de chaque cultivar, il n’y a pas de lien direct entre la date de floraison des cultivars et leur sensibilité au feu bactérien. Cependant, les cultivars avec une floraison étalée sont plus sensibles au feu bactérien puisqu’ils peuvent être infectés sur une plus longue période. C’est le cas notamment de certains cultivars utilisés pour la pollinisation (ex. : Wealthy) et la Gala.
Choix de la pépinière
Les arbres vendus en pépinière peuvent facilement être porteurs de la maladie, mais sans qu’aucun symptôme ne soit visible (asymptomatique). Les arbres asymptomatiques sont aussi la cause principale d’introduction de souches résistantes à la streptomycine2. Il peut s’écouler quelques années avant qu’un arbre contaminé à la pépinière présente des symptômes (infection latente). Aucun programme de certification n’existe pour assurer que les arbres sont exempts de maladie. Il est donc important de bien choisir la source des arbres. Les pépinières ne devraient jamais récolter le bois de greffe dans des vergers avec un historique de feu bactérien puisque le bois de greffe en apparence sain, est parfois porteur de la maladie (population endophyte)3.
Plantation et arbres non en production
L’année de plantation, la floraison des nouvelles parcelles est presque toujours décalée par rapport à la floraison des parcelles établies. Cet écart favorise le feu bactérien de deux façons : premièrement, les populations bactériennes ont le temps de se développer dans les parcelles avoisinants les nouvelles plantations et le risque de contamination est donc accru; deuxièmement, la température généralement plus chaude lors des floraisons tardives permet aux bactéries de se multiplier sur les fleurs des nouveaux pommiers. Or toutes les infections sur des arbres très jeunes et en forte croissance mènent invariablement à des dommages importants. Conséquemment, il est absolument essentiel d’éliminer cette floraison et différentes solutions sont possibles : a) éliminer les fleurs des nouveaux vergers à mesure qu’elles ouvrent (manuellement ou chimiquement), b) s’assurer de bien les protéger avec des produits efficaces (ex. : cuivre, streptomycine, kasugamycine, BLOSSOM PROTECT), c) acheter des arbres traités de sorte qu’ils ne fleuriront pas la première année. Par exemple, les arbres traités 3 fois en pépinière avec GA3 ou GA4+7 (250 mg·L–1) produisent très peu de fleurs la première année4.
- L’élimination manuelle des fleurs est fastidieuse, mais est utilisée largement. Les traitements pour brûler les fleurs (ex. : bouillie soufrée) sont possibles, mais leur efficacité dans ce contexte n’est pas connue.
- Sur des arbres non en production, la phytotoxicité du cuivre n’est pas un problème. Cependant, le cuivre a une efficacité limitée durant la fleur. Malgré l’efficacité limitée, un traitement au cuivre sur les nouvelles plantations a l’avantage de réprimer une partie de la population de bactéries résistantes à la streptomycine qu’on peut trouver sur les arbres en provenance des pépinières américaines, même sur des arbres en apparence exempts de symptômes. Comme le cuivre s’accumule et qu’il est toxique pour l’environnement (notamment pour les vers de terre) (fiche 50), son usage est controversé.
- L’année précédant la plantation, il est possible de traiter les jeunes arbres avec une hormone de croissance végétale (giberelline) pour inhiber l’induction florale et empêcher la production de bourgeons floraux pour l’année suivante.
En cas d’attaque sur les très jeunes arbres, il est possible d’éliminer les parties atteintes en coupant dans le bois sain en amont, mais souvent l’arbre est condamné et il est souvent plus rentable de l’arracher.
Âge des pommiers
Les risques de mortalité liés au feu bactérien sont particulièrement élevés dans les vergers de moins de 7 ans, principalement à cause de l’invasion possible du porte-greffe. Lorsque les pommiers sont plus âgés, les dommages sont limités aux branches et l’invasion du porte-greffe risque beaucoup moins de causer la perte de l’arbre. Dans les cultivars moins sensibles (ex. : McIntosh, Empire, Spartan), la maladie peut passer inaperçue pendant la saison et néanmoins causer la mort de l’arbre parce que la bactérie a pu circuler jusqu’au porte-greffe sans provoquer de symptômes sur les branches. C’est pourquoi lors des années à risque très élevé, les traitements au printemps sont recommandés sur tous les jeunes arbres sur porte-greffes sensibles, sans égard au cultivar.
Interventions annuelles
Selon le cas de figure, les principales recommandations d’interventions se résument en trois étapes : l’éradication des foyers par la taille pendant la saison morte, des traitements au printemps en cas de risque pendant la période florale et éventuellement des stratégies d’urgence qui comprennent des traitements et l’éradication des symptômes par une taille spécifique en été.
Taille des chancres bactériens à l’automne et durant l’hiver
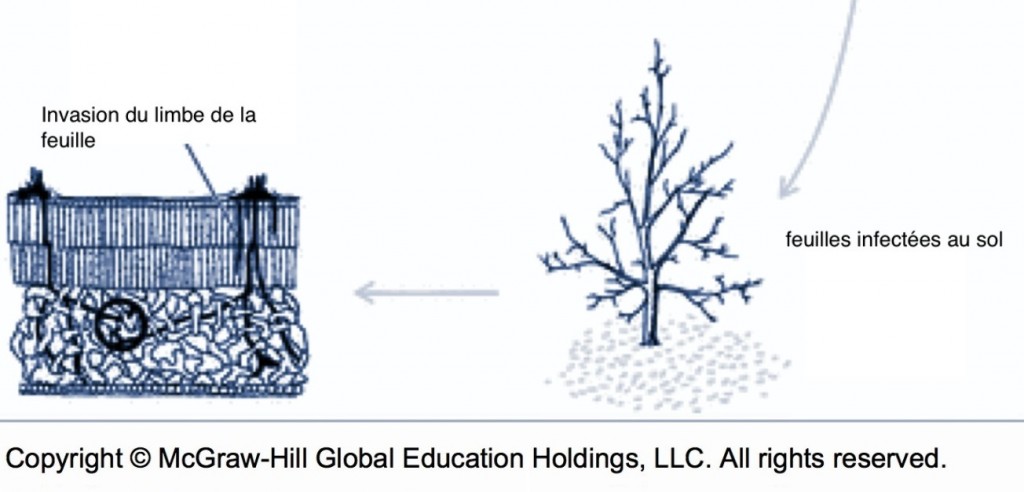
Dans les vergers où des symptômes de feu bactérien ont été détectés, l’élimination des chancres par la taille de dormance contribue à réduire le nombre de foyers actifs pour les années suivantes. Le meilleur moment pour effectuer cette taille est avant la chute des feuilles pour faciliter la localisation des branches affectées5.
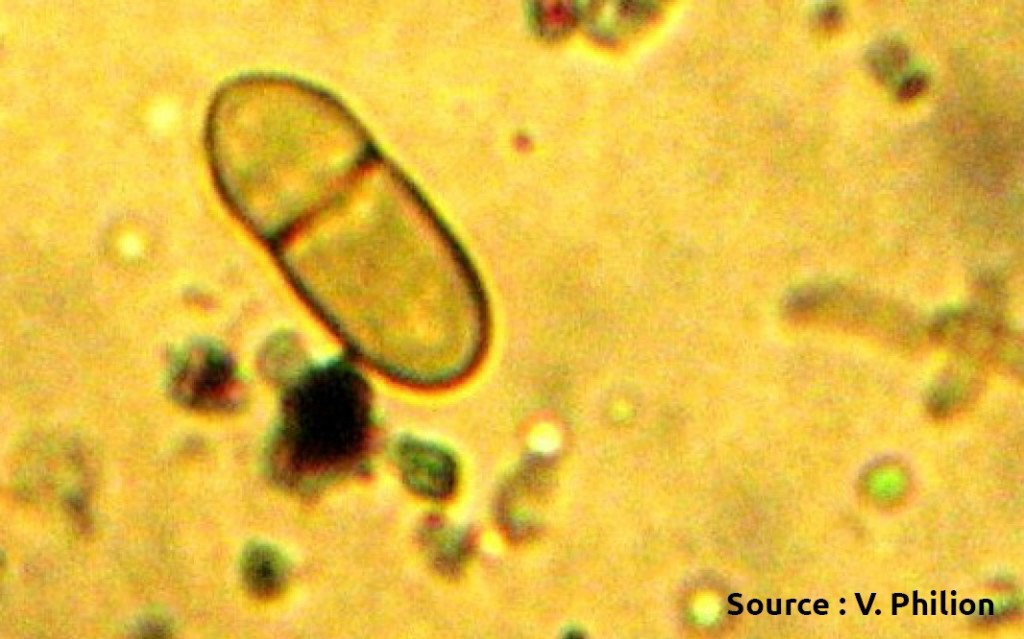
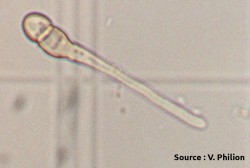
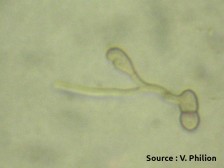
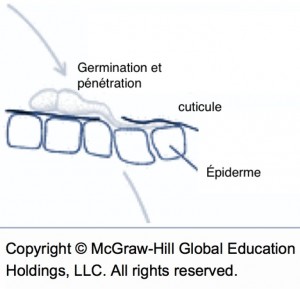
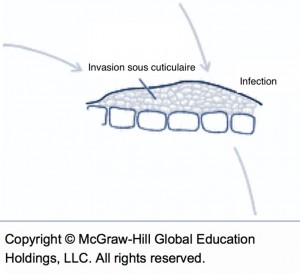
Les chancres à bordure indéterminée (voir la fiche 105) sont beaucoup plus actifs que les chancres à bordure déterminée et devraient être ciblés pour l’élimination. Il est possible de les éliminer par curetage, mais il faut s’assurer de les éliminer entièrement et donc de cureter jusque dans le bois apparemment sain. . Le curetage peut être fait avec une scie à chaine, des couteaux d’horticulture ou même des gouges5. Quand c’est impossible, il faut éliminer la branche porteuse. Il faut surtout éviter d’éliminer seulement les branches mortes et laisser le chancre à la base en place. Comme la localisation des chancres peut être difficile, il est souvent utile de passer deux fois par rangée, idéalement en sens inverse et à un autre moment de la journée pour éviter l’éblouissement et visualiser les branches par un autre angle. Dans bien des cas, les arbres bien nettoyés ne sont plus porteurs de la maladie. Autrement, le nettoyage contribue néanmoins à diminuer l’inoculum même si les plus petits chancres passent inaperçus. Il arrive parfois que le feu bactérien resurgisse sur les mêmes arbres pendant des années. Dans ces cas, il est préférable d’arracher les arbres atteints. Lors de la taille pendant la saison de dormance, les risques de contagion avec les outils ou par le bois de taille sont nuls.

Pousse infectée par le feu bactérien, issue d’un chancre laissé en place durant l’hiver.
Interventions au printemps (préfloral et floraison)
Nettoyer les abords des vergers : La période préflorale du pommier est le meilleur moment pour localiser et éliminer les pommiers sauvages, aubépines, sorbiers (cormiers), amélanchiers et autres hôtes alternes qui fleurissement un peu avant les vergers commerciaux et qui maintiennent des sources d’inoculum à proximité des vergers. L’élimination des hôtes alternes, lorsque possible, est certainement la méthode préventive la plus ancienne5 et une des plus efficace pour limiter les risques. Quand elle est possible, une gestion sévère des plantes sensibles aux abords des vergers peut réduire le risque de 90 %6.
Irrigation, drainage et humidité dans le verger : Pendant la période de la floraison, la disponibilité de l’eau dans le sol a un impact important sur la sévérité de la maladie. Corriger le drainage peut aider à réduire la sévérité des infections. Limiter l’irrigation (goutte à goutte, etc.) au minimum ou attendre la période post florale avant d’irriguer. Limiter l’apport en eau ralentie la multiplication bactérienne sur les stigmates et limite l’entrée des bactéries dans l’arbre en cas d’infection7,8. L’humidité dans l’air facilite la formation de rosée qui peut provoquer l’infection. Limiter la croissance du couvre sol aide à réduire la transpiration et fait baisser l’humidité dans le verger.
Fauchage des fleurs : Plusieurs plantes qui ne sont jamais affectées par le feu bactérien contribuent par leur floraison à augmenter la population bactérienne en verger9,10. Le fauchage des pissenlits, du trèfle et d’autres plantes en fleurs pourrait limiter la contamination des fleurs de pommiers.
Fertilisation azotée : Les apports d’azote favorisent la croissance qui en retour augmente la sensibilité au feu bactérien. L’azote appliqué au sol au printemps est particulièrement problématique puisqu’il devient disponible à l’arbre seulement en cours d’été, au moment où la croissance favorise la propagation du feu. Limitez au minimum tous les apports d’azote.
Traitements phytosanitaires : Au niveau des pulvérisations, il existe trois fenêtres d’interventions possibles avant l’apparition d’éventuels symptômes. Le choix des traitements et leur combinaison éventuelle est fonction du risque appréhendé et du mode de culture. La décision d’appliquer du cuivre doit être prise au débourrement selon l’historique de feu local, mais avant de connaître les risques climatiques de la saison, alors que les traitements durant la floraison et de fin de floraison peuvent tenir compte des risques climatiques qui ont eu cours pendant la floraison.
- Cuivre : Un traitement de cuivre fixe (oxychlorure de cuivre) diminue la production bactérienne des chancres et est recommandé pour au moins les deux printemps suivant une infection. Dans la documentation classique, on réfère à un traitement au stade dormant. Or, le cuivre appliqué trop tôt a peu d’impact sur le feu bactérien. Il est préférable de retarder le traitement et de l’appliquer après le débourrement, voire même au stade du débourrement avancé, mais pas plus tard qu’au stade du pré-bouton rose, puisque le cuivre est phytotoxique et peut causer de la roussissure sur les fruits de certains cultivars s’il est appliqué trop tardivement. Le traitement peut être fait en mélange avec l’huile supérieure. Le cuivre appliqué à ce moment est également efficace comme traitement contre la tavelure.
Interventions durant la floraison
Traitements floraux : Pendant la floraison, des applications de bactéricides et/ou de BLOSSOM PROTECT (levure antagoniste) sont recommandées selon l’âge et le cultivar lorsque des sources de bactéries sont présentes, que les conditions climatiques favorisent la multiplication bactérienne et que des conditions d’infection sont prévues avec les modèles (ex. : Cougarblight et RIMpro-Erwinia).
Bactéricides : L’utilisation des antibiotiques en agriculture est un sujet de controverse. Il existe deux bactéricides très efficaces homologués au Canada qui peuvent être utilisés pendant la floraison. Une application de streptomycine ou de kasugamicyne à une dose suffisante dans les 24 à 48 heures précédant ou pour la streptomycine dans les 24 heures suivant le moment de l’infection reste l’intervention la plus flexible et la plus efficace pour réprimer le feu bactérien. Voir fiche 49.
Les antibiotiques protègent surtout les fleurs ouvertes au moment du traitement et les traitements ne sont pas redistribués par les pluies. La streptomycine appliquée sur les fleurs avant leur éclosion est en partie absorbée mais n’a qu’un effet partiel11. Les fleurs nouvellement écloses après le traitement doivent faire l’objet d’applications additionnelles lorsqu’elles sont à risque.
Les traitements avec des antibiotiques devraient idéalement être séparés des autres traitements puisque les mélanges peuvent influencer l’efficacité12. Cependant, cette baisse d’efficacité n’a pas été observée avec des formulations récentes. Même si les antibiotiques sont graduellement dégradés par la lumière, la période de sensibilité de chaque fleur est aussi limitée dans le temps. Au bilan, les fleurs traitées restent bien protégées jusqu’à la fin de leur période de sensibilité à la maladie, malgré la dégradation de l’antibiotique.
Concrètement, les traitements réalisés plus de 48 heures avant le moment de l’infection présumée peuvent laisser un nombre considérable de fleurs non traitées, où les bactéries pourront atteindre des populations suffisantes pour provoquer une infection. Ça n’arrive pas tous les ans. Les fleurs ouvertes moins de 48 heures avant l’infection ne présentent pas trop de risques, puisque la population bactérienne n’a pas le temps d’atteindre les seuils à risque. À l’inverse, retarder le traitement après le moment de l’infection est risqué. En effet, l’efficacité du traitement diminue à mesure que les bactéries envahissent la plante et cette stratégie accélère le développement de la résistance. De plus, les conditions météos peuvent rendre difficiles les interventions. À la dose recommandée sur des arbres de gabarit moyen (ex. : 1 kg/ha), les traitements jusqu’à 24 h après l’infection sont normalement assez efficaces13. Consultez la fiche 49 du guide PFI pour plus de détails.
La résistance de la bactérie à la streptomycine est fréquente aux États-Unis et pourrait nous atteindre un jour. Il existe deux mécanismes majeurs de résistance. La forme la plus fréquente (mutation de rpsl) est surtout confinée à l’ouest des États-Unis. C’est une mutation spontanée dont la propagation est favorisée par un usage fréquent des antibiotiques. La deuxième forme (strA-strB), n’est pas transmissible entre les souches et sa présence est donc associée à des mouvements d’arbres porteurs14. Actuellement, la résistance à la streptomycine est fréquente seulement dans l’Ouest américain, canadien et au Michigan. Depuis 2001, certains cas sont apparus dans l’ouest de l’état de New York et les deux formes de résistances étaient présentes lors d’un dépistage extensif effectué en 2014. Quoique rare, elle subsiste à ce jour15. Selon les informations disponibles, la résistance dans l’état de New York est liée à l’importation d’arbres malades porteurs de bactéries résistantes en provenance de l’ouest américain et d’un usage fréquent de la streptomycine2.
Il n’y a pas de résistance aux antibiotiques rapportée à ce jour au Québec malgré un suivi étroit, notamment en 2016 (V. Toussaint, AAC comm. pers.). Cependant, si vous avez des doutes quant à l’efficacité de la streptomycine, le Laboratoire de diagnostic en phytoprotection du MAPAQ peut évaluer la résistance à partir de vos symptômes et les résultats sont disponibles en 10 jours.
Certaines mesures simples sont possibles pour retarder l’arrivée de la résistance à la streptomycine. En principe, une rotation entre les antibiotiques pourrait permettre de retarder d’éventuels problèmes de résistance. En pratique, le coût de la kasugamycin n’incite pas à faire des rotations. D’autres mesures plus efficaces consistent à : traiter la streptomycine seulement lorsque c’est nécessaire, limiter les traitements à la période florale, ne pas appliquer de streptomycine dans un verger affecté sans avoir pris d’autres mesures pour éliminer les symptômes et ne jamais utiliser de bois de greffe ou importer des arbres d’un verger où la maladie est présente. Aucun cas de résistance n’a été rapporté quand ces mesures de prévention étaient suivies. À l’inverse, la résistance est fréquente partout où l’usage de la streptomycine est abusif. Or, une fois que la résistance à un antibiotique est installée, elle est permanente.
Alternatives aux antibiotiques : Différentes alternatives aux bactéricides ont été homologuées pour réprimer les infections florales. Les antagonistes bactériens (SERENADE, BLOOMTIME) ont démontré une certaine efficacité, quoique moindre que celles des antibiotiques. Actuellement, la seule alternative aux antibiotiques qui soit aussi efficace qu’eux est le BLOSSOM PROTECT, une levure antagoniste du feu bactérien. Le moment d’utilisation de ce produit est similaire à celui des antibiotiques, sauf que les conditions d’usage sont un peu plus restrictives. Les traitements de BLOSSOM PROTECT doivent être appliqués au minimum 18 h avant le moment de l’infection. Les traitements réalisés plus de 48 h avant l’infection ne permettent pas toujours de couvrir le risque pour les fleurs ouvertes après le traitement. Lorsque les conditions sont très favorables à la maladie, l’intervalle maximum entre les traitements est donc de 48 h. Ce scénario est assez rare. Dans les années très à risque, un traitement par jour pourrait être nécessaire pour éviter un trou de plus de 48 h entre les applications. Par exemple, un traitement le 21 mai AM et impossibilité de traiter le 23 mai AM, alors il vaut mieux traiter le 22 mai en soirée (intervalle de 36 h) que d’attendre le 23 mai PM (intervalle de 56 h). Cependant, multiplier les traitements pour couvrir toutes les fleurs augmente considérablement les coûts et les risque de roussissure, surtout quand les conditions sont pluvieuses. Limitez à 3 ou 4 traitement par bloc au maximum.
De plus, comme il s’agit d’un champignon, ce produit est incompatible en mélange avec la plupart des fongicides, sauf quelques exceptions.
Fongicides compatibles en mélange avec Blossom Protect
Groupe 3 : Cevya, Kenja
Groupe 7 : Sercadis, Fontelis
Groupe 9 : SCALA, VANGARD
Groupe 11 : Flint
Mélanges : Merivon, Luna Tranquility, Luna Sensation
Autres: Soufre (ex. : KUMULUS), Phosphonate.
Par contre, tous les fongicides peuvent être utilisés un jour avant ou deux jours après un traitement avec BLOSSOM PROTECT sans nuire à son efficacité. Autrement dit, il faut laisser le Blossom Protect s’installer et agir (2 jours) avant d’appliquer un fongicide incompatible.
Dans le cas des engrais et régulateurs utilisés à la floraison, Blossom Protect est compatible en mélange avec l’urée et Apogee, mais incompatible avec Solubor (Etidot).
Synchronisation des traitements : Il est possible d’appliquer les traitements antibiotiques et le BLOSSOM PROTECT selon les indications de l’étiquette, soit en lien avec l’ouverture des fleurs plutôt qu’en lien avec le risque de feu bactérien. Cependant, cette approche, qui peut nécessiter jusqu’à trois ou quatre traitements pour chaque cultivar, résulte le plus souvent en des traitements inutiles quand les risques sont faibles et peut néanmoins faire rater le moment optimal quand les risques sont élevés. Selon les années, de zéro à un maximum de deux traitements peuvent être requis par cultivar. Pour optimiser les traitements, l’utilisation d’un logiciel peut être utile. À cet égard, le simulateur RIMpro-Erwinia, disponible en ligne peut vous aider à déterminer si une intervention est nécessaire et cibler le moment le plus propice pour le traitement.
Comme les traitements ne protègent que les fleurs ouvertes, la nécessité d’un traitement additionnel est établie en fonction du risque encouru sur les nouvelles cohortes de fleurs ouvertes après le traitement. Par exemple, pour un traitement le 15 mai, il faut établir si les fleurs en éclosion à partir du 16 mai sont à risque.
En pratique, la contamination des premières fleurs de la saison est très rare (fiche 104) et l’infection des premières fleurs nouvellement ouvertes de l’année ne peut pas provoquer une infection grave. Les traitements en tout début de floraison sont en pratique jamais requis. À l’inverse, les dernières fleurs à ouvrir sont plus souvent contaminées parce que les insectes ont pu distribuer les bactéries sur l’ensemble du verger. Il est donc important de bien identifier les périodes d’infections potentielles sur les dernières fleurs à ouvrir. Les traitements réalisés plus de 4 jours après la date d’éclosion des dernières fleurs ne sont pas utiles.
En résumé, il vaut mieux attendre autant que possible pour viser un maximum de fleurs ouvertes avant de faire un traitement, mais le traitement doit être appliqué environ un jour avant l’infection.
Suivez avec attention les conditions météorologiques et renouvelez les traitements au besoin. Les risques d’infections et les recommandations de traitement sont diffusés sur le réseau de répondeurs régionaux du MAPAQ en pomiculture.
Autres traitements durant la floraison
Le régulateur de croissance APOGEE ou KUDOS qui est normalement utilisé pour atténuer la croissance des arbres est très efficace pour réduire le feu bactérien sur pousses16,17, autant sur pommier que sur poiriers18. Ce régulateur de croissance n’empêche pas les attaques sur fleurs, mais limite énormément la progression de la maladie en cours d’été. Pour être complètement efficace, le début des traitements ne doit pas être retardé. Le premier traitement peut être appliqué aussitôt qu’au bouton rose19 et devrait être appliqué quand les pousses mesurent environ 5 cm, soit souvent avant la chute des premiers pétales.
Ce produit provoque l’augmentation de l’épaisseur des cellules20, ce qui empêche l’entrée des bactéries dans la pousse. Cette protection des pousses n’est pas parfaite, mais réduit grandement la sévérité des attaques lors des épisodes de grêle ou de temps violent. La période de protection débute environ deux semaines après le traitement et dure approximativement un mois. Sous nos conditions, un deuxième traitement environ trois semaines après le premier est nécessaire pour protéger les arbres partiellement jusqu’à la fin juillet. Par exemple, un traitement le 21 mai et 11 juin pourraient couvrir le risque jusqu’au 13 juillet. Par la suite, les risques de feu diminuent grandement.
APOGEE ou KUDOS ne peuvent se substituer entièrement aux antibiotiques ou au BLOSSOM PROTECT dans les vergers les plus à risque. Par contre, il peut être intégré dans une stratégie de combinaison pour les cas les plus problématiques, ou alors comme pare-feu unique dans les vergers moins à risque. Comme ce produit réduit la croissance des arbres, il n’est pas conseillé dans les très jeunes vergers et son utilisation devrait être validée auprès d’un agronome-conseil. Voir la fiche 49 pour plus de détails sur ces produits.
Éclaircissage hâtif. Une fois la fleur reine pollinisée, il est possible par des applications répétées de provoquer à dessein une phytotoxicité florale pour limiter la pollinisation des fleurs secondaires et favoriser le retour à la fleur. Cette intervention permet de réduire les risques de feu bactérien de 2 façons : 1) les fleurs tuées qui sont inutiles à la production ne permettront pas la multiplication bactérienne, ni l’infection; 2) certains produits comme la bouillie soufrée ont un effet répulsif pour les abeilles.
En production biologique, le mélange de bouillie soufrée et d’huile de poisson est le traitement de référence pour cet usage. L’huile de poisson peut être substituée par de l’huile minérale ou végétale. En production PFI, l’éclaircissage floral est souvent réalisé avec du thiosulfate d’ammonium (ATS). Malheureusement, ce produit n’a pas d’efficacité contre le feu bactérien. Les applications répétées de bouillie soufrée (20 L/ha) en mélange avec de l’huile d’été (10 L/ha) sont efficaces à la fois pour l’éclaircissage et réprimer le feu bactérien (rapport IRDA-1-16-1810). Le bicarbonate de potassium (30 kg/ha) était moins efficace.
Comme la bouillie soufrée est incompatible avec la levure Blossom Protect, la séquence de traitements doit en tenir compte. Par exemple :
Jour 0 : éclosion de la fleur reine, Jour 2 : application de bouillie soufrée, Jour 4 : application de bouille soufrée, Jour 5 : Blossom Protect appliqué sur les fleurs entièrement écloses.
Éclaircissage mécanique. Les techniques d’éclaircissage mécanique comme l’appareil Darwin peuvent contribuer légèrement à propager les bactéries déjà présentes dans le verger21. Cependant, le risque d’aggraver le feu bactérien avec cet appareil est faible puisque l’éclaircissage mécanique a normalement lieu avant l’arrivée des bactéries. De plus, Darwin pourrait potentiellement réduire l’impact du feu bactérien en diminuant le nombre de portes d’entrées naturelles pour la bactérie. Les blessures transitoires créées par les fils rotatifs sont probablement moins favorables pour l’envahissement bactérien que les glandes nectarifères des fleurs. Notez cependant que l’usage simultané de la bouillie soufrée et de Darwin peut provoquer un éclaircissage trop intensif.
Les stratégies d’éclaircissage floral s’inscrivent en complémentarité dans un plan plus complet de gestion du feu et ne sont pas assez efficaces pour se substituer entièrement aux autres traitements.
Manutention des ruches : Même si les abeilles sont reconnues comme des vecteurs importants des bactéries responsables du feu bactérien, leur rôle dans la pollinisation est souvent incontournable et la gestion du feu bactérien doit en tenir compte en intégrant les traitements appropriés et en retirant les abeilles des vergers dès la pollinisation terminée. Dans tous les cas, la pollinisation dans un verger contaminé n’est pas possible sans propager les bactéries déjà en place. La pollinisation et la contamination sont assurées par les insectes indigènes en absence d’abeille.
Les bactéries ne peuvent pas survivre à l’hiver dans les ruches, mais peuvent subsister en cours de saison22. Conséquemment, les abeilles contaminées par les bactéries peuvent propager le feu par le déplacement des ruches, mais seulement lorsque le déplacement est fait pendant la période de floraison. En dehors de la période de floraison, les abeilles n’ont pas de rôle dans l’épidémiologie du feu. Comme la floraison est presque synchronisée dans les grandes régions de production, le déplacement des abeilles d’un verger à un autre pendant la période de floraison est rare au Québec. Cependant, un déplacement de ruches contaminées vers les régions où la floraison est plus tardive (ex. : Québec) pourrait disséminer la bactérie.
Une fois que les conditions pour une bonne pollinisation ont été atteintes, laisser les abeilles dans le verger constitue un risque inutile de propagation des bactéries responsables du feu bactérien. Le retrait des abeilles du verger une fois la fleur reine pollinisée est une bonne façon de réduire la contamination des fleurs tardives, qui n’ont pas une grande valeur économique et qui sont à l’origine des infections importantes.
La streptomycine et la kasugamycine ne sont pas toxiques aux abeilles et ces antibiotiques peuvent être appliqués sans problème. La streptomycine a d’ailleurs longtemps été utilisée pour réprimer la loque de l’abeille domestique. Par contre, notez que le risque de contamination du miel par les antibiotiques, bien que faible, n’est pas nul. Pour éviter la contamination, il faut de préférence appliquer les traitements après le vol des abeilles, et placer les ruches en bordure du verger afin d’éviter que les résidus n’atteignent la ruche. Il est également possible de recouvrir les ruches d’une bâche avant un traitement en soirée. La contamination possible du miel est un des arguments en faveur du bannissement des antibiotiques, soyez donc vigilants et prudents.
Interventions d’urgence
Même quand toutes les mesures de prévention sont en place, l’apparition de foyers demeure possible en été, notamment à cause des infections qui ont lieu en dehors de la période florale. Quand la maladie est bien gérée, ces sorties de symptômes sont limitées. À l’autre extrême, en absence de prévention, des foyers peuvent apparaître soudainement dans tout le verger. Entre le moment de l’apparition des symptômes et pendant toute la période de croissance, la maladie peut s’aggraver rapidement sur les arbres atteints et contaminer les arbres avoisinants. Tous les vergers affectés peuvent servir de source d’inoculum et peuvent contaminer des vergers de grande valeur et/ou très sensibles à la maladie (Gala, Honeycrisp, etc.) qui sont à proximité. Conséquemment, l’option de ne « rien faire en été » est à envisager seulement dans les parcelles isolées où les risques de contamination aux parcelles environnantes est faible. En absence de risque de contamination, les interventions d’urgence ne sont pas nécessaires dans tous les blocs. Dans les blocs très peu vigoureux, la maladie reste souvent cloisonnée aux bouquets atteints et les interventions peuvent attendre à l’hiver.
Le feu bactérien est une maladie communautaire. Comme d’autres vergers sont souvent limitrophes à la parcelle atteinte, il est important de déployer tous les efforts nécessaires pour limiter la propagation.
Toutes les interventions recommandées lorsque des symptômes apparaissent en cours de saison ont été regroupées dans cette section. Une section spécifique sur les traumatismes décrit les interventions recommandées suivant une tempête dans les vergers où le feu est une menace.
Apogee/KUDOS
Jusqu’à tout récemment les interventions avec le régulateur de croissance prohexadione-Ca après le stade calice étaient considérées peu efficaces23. Il existe cependant deux fenêtres utiles d’intervention d’urgence : Dès la sortie des premiers symptômes ou à la suite d’un traumatisme (ex. : grêle) (voir cette section).
Les applications faites rapidement après l’apparition des premiers symptômes (mi-juin) protègent les pousses saines et limitent la production d’exsudat bactérien sur les pousses déjà atteintes24. Pour profiter au maximum de l’effet, les traitements doivent débuter dès les premiers indices de la maladie, soit avant que les symptômes virent bruns. Appliquez la dose la plus forte recommandée et renouvelez le traitement après deux semaines.
Taille d’éradication : principes : Une taille rapide aide l’arbre à circonscrire la bactérie et à l’emmurer. Les chancres qui peuvent apparaître seront dans ce cas le plus souvent à bordure « définie » et produiront moins d’inoculum l’année suivante. Limiter la propagation en été réduit donc les risques pour l’année suivante. À l’inverse, une progression tardive des symptômes mène à des chancres à bordure « indéterminée » qui sont souvent actifs au printemps suivant. S’il est vrai que l’élimination rapide du feu bactérien dans les arbres en forte croissance peut stimuler la croissance de nouvelles pousses sensibles, les conséquences de retarder la taille sont souvent pires. Quand les symptômes ne sont pas trop nombreux, l’éradication rapide des symptômes par la taille en été est toujours préférable à ne rien faire5. Par contre, quand le nombre de branches atteintes est élevé, la taille peut carrément aggraver la maladie et n’est pas toujours rentable24 notamment sur poiriers25. Dans les cas extrêmes, il est donc préférable de ne pas tailler les branches immédiatement et d’attendre après la récolte pour couper les branches malades. Ainsi, dans les vergers de type standard et/ou les vergers à maturité de cultivars « tolérants » (ex. : McIntosh), la taille n’est pas recommandée. Malgré l’abondance des symptômes, ces arbres sont généralement moins affectés, notamment en présence d’une récolte abondante qui arrête la croissance plus rapidement.
À l’inverse, dans les blocs vigoureux de vergers très à risque de mortalité (notamment les jeunes pommiers greffés sur M26 et M9) où des symptômes sont découverts, il faut rapidement éliminer les foyers à mesure qu’ils apparaissent pour limiter les dégâts. Un retard de deux semaines dans l’éradication des symptômes entraîne six fois plus de dommages qu’une intervention immédiate.
La priorisation des parcelles à tailler est fonction des risques de contamination à d’autres arbres, de la sensibilité de la parcelle (âge, vigueur, cultivar) atteinte et la proportion des branches atteintes. Le principe hospitalier du « triage » selon l’urgence est souvent nécessaire lors des opérations de taille d’éradication estivale.
Trois cas de figures usuels :
- Symptômes limités aux bouquets et cultivars tolérants (ex. : McIntosh) : Les dangers de propagation aux autres parcelles sont moindres en absence d’exsudat et les arbres atteints ne sont pas à risque de mortalité.
- Quelques pousses infectées : Une intervention agressive est toujours rentable.
- Pousses multiples infectées = une intervention agressive peut entraîner plus de problèmes, mais ces cas sont aussi les plus problématiques pour la contamination des parcelles avoisinantes. Le régulateur de croissance Apogee/Kudos (voir cette section) est à considérer.
Priorisation des interventions (démarche commune proposée par le comité de suivi du feu bactérien). Dans chaque cas, les interventions devraient commencer par les cultivars les plus sensibles :
- Intervenir prioritairement sur les parcelles en implantation (commencer par 1 an, 2 ans… ainsi de suite jusqu’à 5 ans)
- Intervenir ensuite sur les parcelles en production ayant une forte croissance végétative (propagation plus rapide)
- Intervenir sur les parcelles infestées à proximité des parcelles mentionnées au point 1 et 2 ci-dessus et à proximité de vos voisins.
- Intervenir ensuite sur les parcelles adultes à croissance plus faible.
Taille d’éradication : méthode : Il est possible d’arracher les bourgeons infectés à la main, mais l’élimination des branches infectées devrait être faite au sécateur. L’arrachage des branches provoque trop souvent une réinfection et la formation de chancres porteurs26. Lorsque les symptômes sont à l’évidence restreints aux bourgeons, il n’est probablement pas nécessaire de tailler plus loin. Quand les pousses sont infectées, on recommande souvent de couper 30–45 cm en amont des symptômes, ou jusqu’à du bois de trois ans ou plus, ou jusqu’à la tige centrale, selon le cas. Il faut adapter la taille aux circonstances. Une taille plus agressive dans des cultivars très sensible sur lesquels la propagation est rapide comme Paulared ou Cortland vous évitera d’avoir à recommencer trop souvent pour arriver au même résultat. Plusieurs recommandent de laisser un moignon de bois plutôt que de faire des coupes agronomiques26. En plus de servir de « pare-feu », ce moignon sera facilement localisable lors de la taille d’hiver et vous permettra d’éliminer plus facilement d’éventuels chancres en bordure de la coupe.
Dans la littérature classique, on recommande souvent de stériliser les sécateurs pour éviter la propagation de la maladie pendant les interventions de taille en été. Or cette recommandation a un impact majeur sur la vitesse des opérations et n’est pas nécessaire. Bien qu’il soit possible de transmettre la maladie avec des outils contaminés et que cette possibilité soit connue depuis très longtemps5, les risques réels sont assez limités. Si la désinfection des outils est néanmoins jugée nécessaire (ex. : contact accidentel avec l’exsudat bactérien), privilégiez le LYSOL ou du VIRKON. L’eau de Javel et l’alcool sont efficaces, mais très corrosifs pour les outils. D’autres formulations non corrosives sont possibles.
En autant que les coupes sont toujours faites par temps sec, dans du bois sain, que les équipes de travail sont conscientes des risques de propagation du feu et qu’elles évitent les contacts entre les symptômes, les sécateurs et les branches saines, l’utilisation de sécateurs stériles et l’élimination du bois de taille n’est pas nécessaire. Lorsque les consignes sont respectées, le risque de propagation est faible et la stérilisation a surtout pour effet de ralentir les opérations de nettoyage. À l’inverse, les opérations d’éradication du feu bactérien par temps pluvieux ou sur des arbres mouillés augmentent fortement les risques de propagation. Toutes les opérations de taille devraient être suspendues par temps pluvieux.
Une fois la branche coupée ou arrachée, jetez simplement les ramifications atteintes au sol centre des rangées, où elles pourront sécher et éventuellement être fauchées. Les risques de contamination à partir du bois laissé au sol est très faible même si les bactéries peuvent survivre un certain temps22. Par temps sec, la bactérie peut difficilement infecter l’arbre à partir d’un point de taille, puisque les plaies de coupes sèchent en quelques heures et deviennent résistantes. Le temps requis pour sortir les branches du verger et les brûler a probablement plus d’impact sur la propagation de la maladie que le risque lié à laisser ces branches au sol. Par ailleurs, faire des tas de branches en vue de les bruler peut favoriser le transport par le vent d’un nombre important de filaments bactériens qui peuvent inoculer les arbres dans leur trajectoire.
Il faut plusieurs interventions de taille pour venir à bout des symptômes. Il faut donc persister dans les efforts. L’arrachage des arbres peut être nécessaire, mais en dernier recours. Les arbres fortement endommagés par la taille d’urgence peuvent être rescapés en quelques années. Ne sous-estimez pas la capacité des arbres à se remettre d’une intervention de taille très sévère. La récolte de l’an prochain et la suivante seront affaiblies, mais dans la grande majorité des cas, il est plus rentable de sauver l’arbre que de l’arracher pour replanter.
- Éclaircissage manuel : Ne combinez pas des opérations comme l’éclaircissage manuel et la taille d’éradication. Tôt ou tard, vous risquez de toucher à de l’exsudat bactérien et d’inoculer les arbres à votre insu. Malgré les pertes au niveau du calibre des fruits, il est préférable de retarder l’éclaircissage jusqu’à la fin de la période de croissance que risquer la propagation du feu.
- Irrigation et drainage : La disponibilité de l’eau dans le sol a un impact important sur la propagation du feu bactérien en été22,27,28. Corriger les problèmes de drainage peut réduire la propagation du feu. Dans les vergers affectés par le feu bactérien, limiter l’irrigation (goutte à goutte, etc.) au minimum tolérable permet de ralentir la sortie des symptômes et limite la sévérité des dégâts sur les branches atteintes.
Traitements en cas de traumatisme
Dans les parcelles voisinant des vergers où des symptômes de feu bactérien sont présents et/ou étaient présents l’an dernier, il est fortement recommandé d’intervenir en cas de grêle en juin ou en juillet. Les tempêtes de grêle avant juin ou après juillet sont beaucoup moins à risque parce que peu de symptômes sont actifs tôt en saison et les risques d’infection disparaissent avec la fin de la croissance tard en été. Dans les blocs où la croissance n’est pas arrêtée, les infections restent possibles en août29.
Deux interventions sont possibles, une application rapide de streptomycine, et/ou une application de Apogee. Il est généralement inutile d’appliquer des traitements fongicides comme CAPTAN ou autre sur les pommiers ou les poiriers suivant un épisode de grêle en juin, puisque les petits fruits verts résistent bien à l’infection par les pourritures. Ailleurs dans le monde, les risques de pourriture noire, de moniliniose ou d’autres maladies peuvent justifier ce traitement, mais ce n’est pas le cas au Québec.
Streptomycine
La streptomycine doit être appliquée dans les quatre heures suivant une tempête, surtout si les conditions climatiques étaient propices au feu pendant la floraison.
N’intervenez que si tous les facteurs de risque sont réunis et seulement en cas de tempête assez violente (vent). Les traitements réalisés jusqu’à 12 heures après la tempête sont probablement encore efficaces à 50 %, mais passé ce délai, la bactérie est internalisée dans le bois et échappe à l’action des antibiotiques. Le traitement peut être fait sur du feuillage encore humide, mais à condition que la pluie soit terminée et que le feuillage soit en cours de séchage.
Notez que l’utilisation de la streptomycine est limitée à un total de 5,7 kg/ha par année, soit environ 6 traitements par année, incluant les traitements floraux, et qu’aucun traitement n’est permis dans les 50 jours précédant la récolte. Pour des cultivars d’été réputés sensibles comme Paulared, cette restriction implique un arrêt des traitements au début de juillet. En pratique, la propagation du feu bactérien est limitée à la période de croissance des arbres et les orages à la fin juillet et en août sont donc beaucoup moins à risque pour la propagation du feu. L’éclaircissage manuel est interdit dans la parcelle dans les 14 jours suivant une application de streptomycine.
Il faut seulement traiter les parcelles où les symptômes ont été enlevés par la taille et les blocs sains à proximité. Traiter des vergers où l’on trouve de nombreux foyers actifs est la meilleure façon de sélectionner des populations de bactéries résistantes à la streptomycine. Une approche plus conservatrice quant à l’utilisation de la streptomycine a permis de garder cet outil de lutte, alors que dans les états où la streptomycine a été utilisée abusivement, ce produit n’est plus efficace.
Dans les blocs de verger où le régulateur de croissance APOGEE a été appliqué lors de la floraison, la propagation du feu bactérien est beaucoup moindre que dans les blocs non traités. Réservez vos interventions à la streptomycine là où elles sont le plus nécessaires.
Apogee/Kudos
Un traitement avec le régulateur de croissance dans les jours suivants une tempête de grêle est recommandé pour trois raisons : pour ralentir la progression du feu, limiter la poussée de croissance des arbres qui survient quand les arbres sont endommagés et ainsi limiter la perte des bourgeons floraux sur le bois de 2 ans. Ce dernier effet permet de régulariser la production dans l’année suivant la grêle30.
Pratiques inefficaces
En raison des conséquences potentiellement désastreuses de cette maladie, différentes pratiques ont été suggérées et rapidement adoptées par les producteurs sans que leur efficacité n’ait été démontrée. Parmi les pratiques les plus usuelles, certaines ont fait l’objet d’études qui ont démontré leur inefficacité ou même leur nuisibilité.
Usage abusif des antibiotiques
La pire pratique consiste à traiter les arbres porteurs de nouveaux symptômes avec des antibiotiques. Il ne faut jamais appliquer de streptomycine ou de kasugamycine dans les vergers où des symptômes de brûlure sont déjà apparents. Ces applications de « désespoir » ne peuvent qu’empirer votre problème à moyen terme. D’une part, les antibiotiques ne sont pas assez systémiques ou efficaces pour « guérir » et il est donc trop tard pour appliquer ces produits. D’autre part, une application après l’apparition des symptômes a comme effet de sélectionner les bactéries les plus résistantes à ces produits. La vitesse de sélection de la résistance sous ces conditions est rapide. Presque tous les cas confirmés de résistance à la streptomycine aux États-Unis ont été causés par des traitements sur des symptômes déclarés.
Par ailleurs, la streptomycine est peu efficace pour empêcher l’infection des pousses végétatives. Seules les fleurs peuvent adéquatement être protégées par les antibiotiques. Dans les blocs de verger où les symptômes sont déjà visibles, il est préférable de se contenter d’éliminer les sources d’inoculum.
L’utilisation abusive des antibiotiques ne réduit pas davantage la maladie, mène à la résistance et nuit à l’image de l’industrie.
Application d’insecticides pour éliminer les insectes vecteurs
Même si plusieurs insectes ont un rôle reconnu ou soupçonné dans la propagation estivale du feu bactérien, les traitements insecticides en été, même appliqués à répétition, ont rarement un impact mesurable sur la sévérité de la maladie. L’effet combiné du vent et de la pluie ont plus d’impact sur la propagation des symptômes que les insectes vecteurs en cours d’été31.
Applications florales ou automnales de cuivre
Le cuivre a une efficacité reconnue au printemps pour limiter les infections de feu bactérien. De même, les traitements en été peuvent ralentir la propagation du feu. Cependant, le cuivre à faible dose (ex. : 900 g de formulation, soit 450 g de cuivre métallique) est peu efficace durant la floraison32 et ne peut pas remplacer la streptomycine. Les applications à dose plus forte risquent de provoquer une rugosité inacceptable sur fruits. Par ailleurs, les traitements de cuivre appliqués après la récolte qui servent à lutter contre les chancres d’origine fongique n’ont pas d’effet notable pour diminuer la quantité de bactéries hivernantes.
Applications estivales et automnales de SERENADE
Le produit SERENADE est d’efficacité variable et réputé peu efficace en été.
Pratiques non validées
L’inoculation des racines avec des mychorizes lors de la plantation pourrait réduire les risques de feu bactérien33. Cependant, ces résultats n’ont jamais été confirmés ou infirmés.
L’utilisation d’huile en été ou de pesticides formulés en partie avec de l’huile augmente la production des filaments bactériens et peut donc accroître les risques de dissémination de la maladie34. Les vergers non traités avec des pesticides à base d’huile auraient moins de problèmes que les vergers traités34.
Références
- Farkas Á, Mihalik E, Dorgai L, Bubán T. Floral traits affecting fire blight infection and management. Trees-Struct Funct 2012;26:47‑66.
- Cox KD. Managing fire blight in 2016. Scaffolds fruits journal 2016;25.
- Tancos KA, Borejsza-Wysocka E, Kuehne S, Breth D, Cox KD. Fire Blight Symptomatic Shoots and the Presence of Erwinia amylovora in Asymptomatic Apple Budwood. Plant Dis. 2016;101:186‑91.
- Lordan J, Robinson TL, Sazo MM, et al. Use of Plant Growth Regulators for Feathering and Flower Suppression of Apple Nursery Trees. HortScience 2017;52:1080‑91.
- Jackson HS. Fire blight of pear and apple. Oregon Agricultural College and Experiment Station, 1910. Disponible sur : https://ir.library.oregonstate.edu/concern/administrative_report_or_publications/rf55z8808.
- Van Teylingen M. Ornamental hosts of Erwinia amylovora and the effect of the fire blight control policy in the Netherlands. In: IX International Workshop on Fire Blight 590 2001.81‑7.
- Sholberg PL, Boulé J. Effects of water stress/drought on fire blight. Dans: XI International Workshop on Fire Blight 793. ISHS; 2007. p. 363‑8.
- Pusey PL. The role of water in epiphytic colonization and infection of pomaceous flowers by Erwinia amylovora. Phytopathology. 2000;90(12):1352–1357.
- Weißhaupt S, Köhl L, Kunz S, et al. Alternative inoculum sources for fire blight: the potential role of fruit mummies and non-host plants. Plant Pathol 2015;n/a-n/a.
- Johnson KB, Sawyer TL, Temple TN. Rates of Epiphytic Growth of Erwinia amylovora on Flowers Common in the Landscape. Plant Dis 2006;90:1331‑6.
- Yoder KS, Cochran AE, Royston WS, Kilmer SW. Laboratory evaluation of Agri-Mycin for systemic protection of unopened Golden Delicious and Rome Beauty apple blossoms from fire blight, 1999. Plant Dis Manag Rep. 1999;CS99FN.
- Shaffer WH, Goodman RN. Compatibility of streptomycin with some fungicides and insecticides. Plant Dis Report 1964;48:180‑1.
- Luepschen NS, Parker KG, Mills WD. Five-year study of fire blight blossom infection and its control in New York. Ithaca, N.Y.: Cornell University Agricultural Experiment Station, 1961.
- Bekoscke K, Breth D, Kuehne S, Borejsza-Wysocka E, Aldwinckle HS, Villani S, et al. Status of Streptomycin Resistant Fire Blight in New York Orchards. N Y Fruit Q. 2014;22(3):5‑8.
- Cox, Kerik D, Wallis A, Carroll, Juliet. Managing fire blight in 2016. Scaffolds fruits journal. 9 mai 2016;25(8).
- Yoder KS, Miller SS, Byers RE. Suppression of fire blight in apple shoots by prohexadione-calcium following experimental and natural inoculation. HortScience. 1999;34(7):1202–1204.
- Yoder KS. Suppression of fire blight of apple shoots by Apogee. Compact Fruit Tree. 2001;34(2):50–53.
- Costa G, Andreotti C, Bucchi F, et al. Prohexadione-Ca (Apogee®): Growth regulation and reduced fire blight incidence in pear. HortScience. 2001;36(5):931–933.
- Cox, Kerik D, Donahue D. New registered uses for Apogee. Scaffolds fruits journal. 23 avr 2018;27(5).
- McGrath MJ, Koczan JM, Kennelly MM, Sundin GW. Evidence that prohexadione-calcium induces structural resistance to fire blight infection. Phytopathology. 2009;99(5):591–596.
- Wallis A, Miranda-Sazo MR, Cox K. Assessing and minimizing the development and spread of fire blight following mechanical thinning and pruning in apple orchards. Plant Dis Am Phytopath Society, 2020;
- Zwet T, Keil HL. Fire blight, a bacterial disease of Rosaceous plants. Agric Handb Sci Educ Adm 1979;
- Schupp JR, Rosenberger DA, Robinson TL, Aldwinkle H, Norelli J, Porpiglia PJ. Post-symptom sprays of prohexadione-calcium affect fire blight infection of « Gala » apple on susceptible or resistant rootstocks. HortScience. 2002;37(6):903–905.
- Philion V, Joubert V. Use of a growth regulator (prohexadione-Ca) and summer pruning as post symptom rescue treatments following a fire blight infection during bloom. J Plant Pathol Springer, 2021;1‑12.
- Shtienberg D, Zilberstaine M, Oppenheim D, Levi S, Shwartz H, Kritzman G. New considerations for pruning in management of fire blight in pears. Plant Dis. 2003;87(9):1083‑8.
- Good to Know: Take a bite out of blight. Good Fruit Grower. 2023. Disponible sur : https://www.goodfruit.com/good-to-know-take-a-bite-out-of-blight/.
- Shaw, L. Intercellular humidity in relation to fire blight susceptibility in apple and pear. Agricultural Experiment Station, 181. : Cornell University, 1935.
- Schouten HJ. Multiplication of Erwinia amylovora in fruit-trees. 1. A simulation study on limitations imposed by temperature and water, weather and soil. Eur J Plant Pathol 1991;97:171‑86.
- Ockey SC, Thomson SV. Preventing shoot blight of apple with streptomycin applications following simulated hail injury. In: X International Workshop on Fireblight 704 2004.211‑6.
- Rademacher W, Kober R. Efficient Use of Prohexadione-Ca in Pome Fruits. Eur J Hortic Sci. 2003;68(3):101‑7.
- Biggs AR. Analysis of fire blight epidemics with spatio-temporal distance class analysis. Phytopathology. 1999;
- Aćimović, Srđan G., Meredith, Christopher L. Evaluation of dormant copper sprays with bark penetrating surfactants in reduction of Erwinia amylovora in cankers and of low-rate copper sprays in blossom blight control. N Y Fruit Q 2017;25:15‑20.
- Bastas KK, Akay A, Maden S. A New Approach to Fire Blight Control: Mycorrhiza. HortScience. 8 janv 2006;41(5):1309‑12.
- Keil HL, Van der Zwet T. Aerial strands of Erwinia amylovora: Structure and enhanced production by pesticide oil. Phytopathology. 1972;62:355–361.
Cette fiche est une mise à jour de la fiche originale du Guide de référence en production fruitière intégrée à l’intention des producteurs de pommes du Québec 2015. © Institut de recherche et de développement en agroenvironnement. Reproduction interdite sans autorisation.