Auteur de la première édition : Vincent Philion
Auteur de la mise à jour 2024 : Vincent Philion
Dernière mise à jour par l’auteur : 12 novembre 2024
Cet ennemi du pommier est réglementé en vertu de la Loi sur la protection sanitaire des cultures (voir la fiche sur Le « droit de produire » et la Loi) et les mesures nécessaires doivent être prises pour éviter la propagation aux cultures avoisinantes.
La tavelure est la maladie du pommier la plus importante dans toutes les régions de production du monde où le climat est frais et humide pendant la période de développement des nouvelles feuilles. Dans la plupart des cas, la tavelure est endémique, c’est-à-dire que le champignon qui en est responsable (Venturia inaequalis) est habituellement présent dans l’environnement et que la maladie peut apparaître si les conditions lui sont favorables. La tavelure du poirier (Venturia pyrina) est semblable, mais chaque maladie a ses particularités. Ces maladies sont spécifiques à leur hôte : la tavelure du poirier ne peut pas s’attaquer au pommier et réciproquement1. Les outils développés pour la tavelure du pommier ont tendance à surestimer les infections sur poirier. On trouve un seul autre champignon du genre Venturia sur les pommiers (V. asperata)2, mais les dommages associés à cette espèce sont mineurs3.
Malgré toutes les connaissances et tous les outils de lutte disponibles, la tavelure reste une préoccupation majeure qui a le potentiel de causer de lourdes pertes selon le marché visé. En PFI, la tolérance pour la tavelure est très faible et le moindre symptôme de tavelure sur fruits provoque un déclassement et donc une perte de valeur importante de ceux-ci. La tolérance pour la tavelure est plus grande dans certains marchés de vente directe et pour les fruits destinés à la transformation. Néanmoins, la gestion de la tavelure est inévitable et peut être ajustée selon le niveau de tolérance à la maladie.
Dans cette fiche, le développement de la maladie est expliqué en lien avec les différentes interventions possibles, qui, elles, sont décrites dans les fiches portant sur les stratégies générales de lutte (voir la fiche sur La tavelure : stratégies générales de lutte), la répression des infections primaires (voir la fiche sur La tavelure : traitement contre les infections primaires) et les infections en été (voir la fiche sur La tavelure : traitement d’été).
Développement général de la maladie
Pendant la saison de croissance, le champignon qui cause la tavelure est un qui se propage et infecte le pommier. Durant la saison morte, il survit comme saprophyte, soit passivement et sans propagation. La phase saprophyte a lieu au sol, dans les feuilles mortes de la litière, où le champignon survit en produisant de petites structures quasi sphériques, nommées pseudothèces, qui serviront à sa reproduction et à la production de l’inoculum primaire. Au printemps, l’intérieur des pseudothèces se tapisse de poches, nommées asques, qui sont le lieu de production et de maturation des ascospores ainsi que de leur stockage. Une fois à maturité, les ascospores sont projetées pendant les pluies, au gré des conditions d’éjection, et sont entraînées par les courants aériens qui assurent le transport des ascospores. Les spores flottent jusqu’à ce qu’elles entrent en contact avec une surface dure qui force la déposition des ascospores. Lorsque les conditions de température et de durée d’humectation sont suffisantes, il y a germination et pénétration qui peuvent culminer jusqu’à l’infection primaire. Les éjections peuvent mener à une infection à partir du stade du débourrement des pommiers et se terminent quand l’inventaire des spores est épuisé ou quand les pseudothèces sont dégradés, soit après la nouaison. Les étapes de maturation des ascospores, l’éjection, la germination et l’infection sont illustrées dans le RIMpro, disponible sur le Réseau-pommier.
Les infections réussies deviennent visibles après une période d’incubation lors de l’apparition des symptômes. Ces taches assurent la propagation de la maladie en produisant des spores appelées conidies qui sont éclaboussées pendant les pluies sur des feuilles ou des fruits à proximité des sites d’infections primaires. Encore une fois, si les conditions d’infection sont rencontrées, ces conidies s’attaquent au feuillage et aux fruits et sont à l’origine des infections dites secondaires et de la tavelure sur fruits. Contrairement aux infections primaires, les infections secondaires continuent tout l’été au gré du temps frais et humide et jusqu’à la récolte. Dans les vergers très tavelés, les conidies peuvent parfois et cette tavelure sur bois peut survivre à l’hiver et contribuer aux infections tôt au printemps. Au moment de la mortalité et de la chute des feuilles, la tavelure cesse la propagation par les conidies et produit des filaments mycéliens qui envahissent l’intérieur des feuilles. Le croisement entre ces filaments marque le début de la reproduction sexuée, qui culmine à nouveau par la production des pseudothèces.
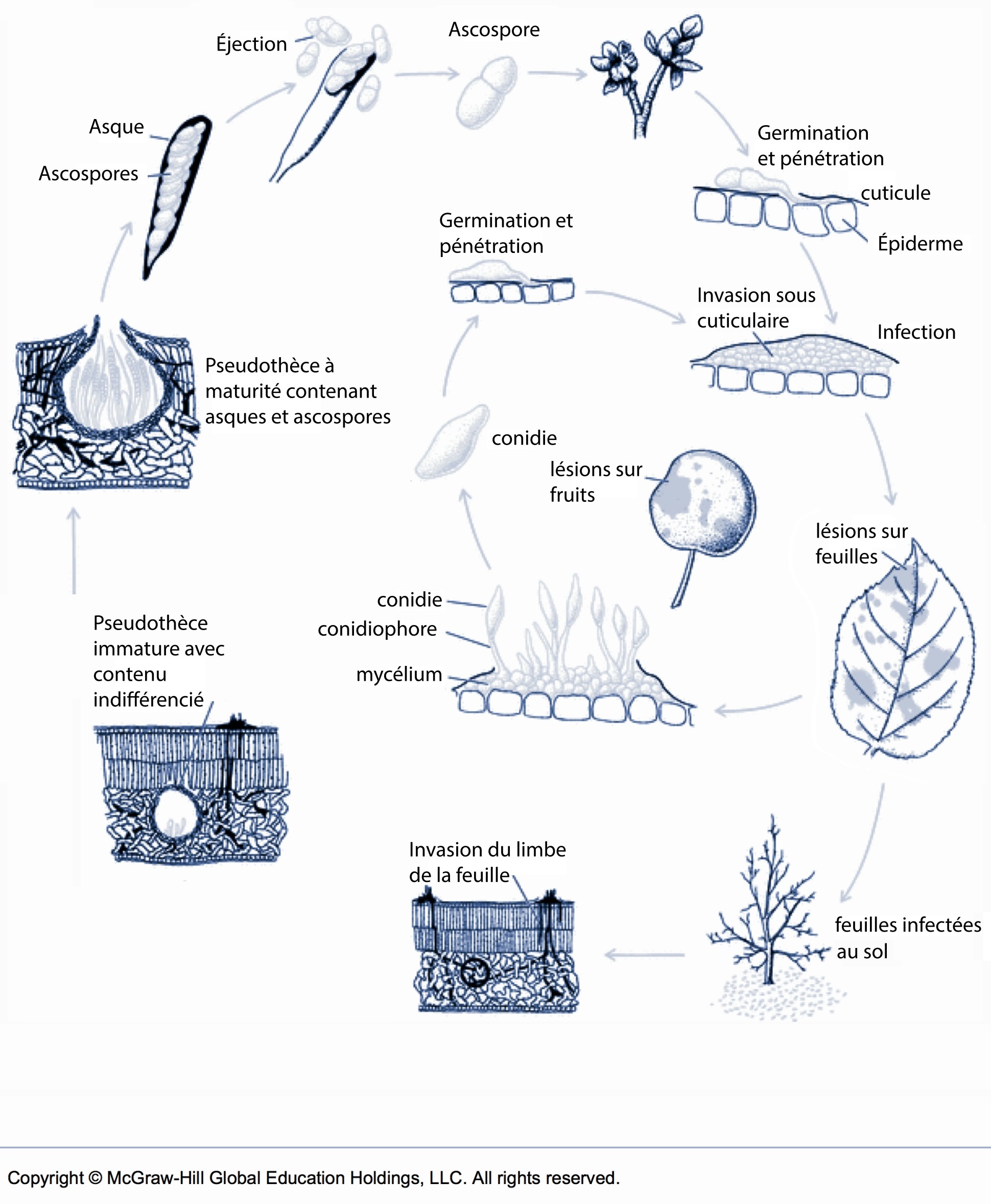
Le cycle de la tavelure du pommier. Traduit et adapté avec la permission des détenteurs de droits (source : McGraw-Hill).
Phase saprophyte
Production de l’inoculum primaire
Dans les semaines suivant la chute des feuilles, les conditions météorologiques influencent la production des pseudothèces dans les feuilles de la litière. Le temps frais et humide favorise la production des pseudothèces alors que les automnes secs y sont défavorables. Lorsque les conditions sont propices et que le feuillage est très tavelé, on peut facilement trouver des centaines de pseudothèces par feuille tavelée au sol. À la fin de l’hiver et au printemps, chaque pseudothèce produit en continu jusqu’à 150 asques contenant toujours huit ascospores chacun, soit un potentiel d’environ 1200 ascospores par pseudothèce. La production de nouveaux asques culmine par l’éjection des spores. La quantité totale d’ascospores réellement produite est tributaire des périodes humides et donc variable à chaque année. En absence de neige ou lorsque le printemps est sec, le potentiel éjectable est réduit. À l’échelle d’un verger, le nombre d’ascospores qui peuvent être éjectées peut donc varier grandement selon l’incidence de la tavelure l’année précédente, les conditions météo en automne, en hiver et au printemps. Quand les conditions sont favorables au champignon, la production peut atteindre des millions d’ascospores par m2 de litière. À l’inverse, quand l’incidence de la tavelure est faible, que des mesures sont prises pour détruire les feuilles de la litière et que la météo n’est pas favorable à la production d’ascospores, la production d’inoculum est fortement atténuée. Dans les vergers très propres, la production d’inoculum peut être inférieure à 100 ascospores par m2 de litière, soit un facteur de 100 000 fois moindre par rapport aux vergers où la tavelure est un problème. La quantité de spores produites est un facteur déterminant pour la gestion de la maladie qui doit servir de guide pour établir votre programme de lutte. La gestion de la tavelure dans les vergers propres est toujours plus simple que dans les vergers à fort inoculum (voir méthodes de lutte pour la réduction de l’inoculum).
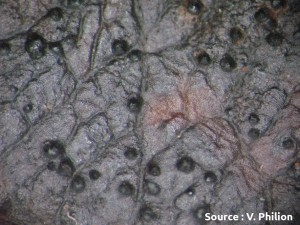
Pseudothèces (source : Vincent Philion, IRDA).
Maturation des ascospores
Les ascospores produites dans les pseudothèces arrivent à maturité graduellement et s’accumulent tout au long du printemps. Quand la période entre la fonte de la neige et le débourrement est très courte et/ou que la litière reste humide, les premières ascospores arrivent à maturité avant la période du débourrement du pommier. Inversement, la maturation est retardée et les premières spores matures ne sont visibles qu’après le débourrement des pommiers lors de printemps secs. Le décalage entre la date de maturation des premières spores et le débourrement peut être jusqu’à deux semaines. Bien que le nombre de spores produites varie d’un cultivar à l’autre, la vitesse de maturation des ascospores n’est généralement pas influencée par le cultivar4,5. Il est probable que les différences de vitesse de maturation observées dans certaines études6 soient liées à un grand décalage dans la date de chute des feuilles entre les cultivars.
Dans tous les cas, l’accumulation des spores débute lentement et s’accélère pour atteindre son maximum, habituellement au moment de la floraison. Cependant, le champignon n’est pas toujours synchronisé avec la phénologie de l’arbre et le pic d’éjection peut arriver bien avant ou après la floraison. Lors de printemps plus secs, la maturation des spores est retardée et peut culminer après la floraison. L’accumulation des spores matures diminue par la suite à mesure que la réserve de spores s’épuise. Tant que de nouvelles ascospores arrivent à maturité, les risques d’éjection et d’infection demeurent à chaque nouvelle pluie. Les différents patrons de maturation ont un impact sur la gestion des traitements, notamment pour établir la date du premier traitement et la fréquence des traitements à mesure que le risque progresse.
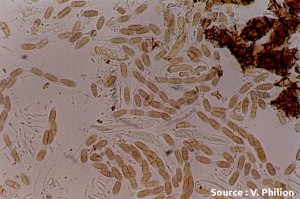
Ascospores (source : Vincent Philion).
Phase parasite
Conditions d’éjection
Les éjections sont possibles dès que des spores sont à maturité, qu’un film d’eau est présent sur les feuilles de la litière et qu’il y a présence de lumière. En présence d’eau libre, les pseudothèces sont graduellement imbibés par osmose et les asques à maturité gonflent jusqu’à déborder par une ouverture du pseudothèce nommée ostiole. La pression osmotique de cet apport d’eau finit par faire rompre l’asque et les ascospores sont projetées une par une par l’ostiole. Par la suite, d’autres asques à maturité débordent à leur tour dans l’ouverture et les éjections continuent jusqu’à l’épuisement de la réserve de spores à maturité ou dès que le film d’eau à la surface de la litière disparaît.
La nuit, un mécanisme biologique inhibe presqu’entièrement l’éjection des spores. La plupart des éjections sont donc provoquées par des pluies de jour. Une faible quantité de pluie (ex. : 0,1 mm) peut suffire pour débuter les éjections. Les rosées importantes qui persistent après le lever du soleil peuvent aussi suffire pour provoquer une éjection. Seule une petite fraction des spores est éjectée à la noirceur. Le mécanisme d’inhibition nocturne est fonctionnel jusqu’à ce qu’environ 80 % des spores soient éjectées ou que plus d’un tiers des ascospores de la saison soient accumulées dans les pseudothèces. Quand ces conditions sont rencontrées, l’intensité des éjections la nuit est similaire à celle observée pour les éjections durant le jour. Néanmoins, les éjections nocturnes représentent sur toute la saison moins de 10 % du total.
Il est possible que le mécanisme qui empêche l’éjection la nuit permette principalement aux spores enfouies dans les couches inférieures de la litière d’arriver à maturité sans qu’elles soient à risque d’être éjectées et interceptées par la litière. Ainsi, le déplacement par le vent des feuilles au sol expose d’autres feuilles où des spores à maturité ont pu s’accumuler et les rend disponibles à l’éjection.
L’intensité des éjections dépend du nombre de spores à maturité et de la température. La neige ne permet pas les mécanismes osmotiques et/ou bloque le passage des spores, mais l’eau à 0 °C permet en principe l’éjection. Cependant, la vitesse d’éjection est quasiment nulle près du point de congélation (0 à 2 °C)7 et augmente ensuite graduellement jusqu’à environ 8 °C. Quand la température n’est pas limitative, les spores matures au début de la pluie sont généralement éjectées au cours des trois premières heures d’une pluie continue. Comme les éjections sont fortement influencées par la pluie, la lumière et la température, il est possible d’interférer avec les éjections naturelles, mais cette stratégie n’est pas sans risque.
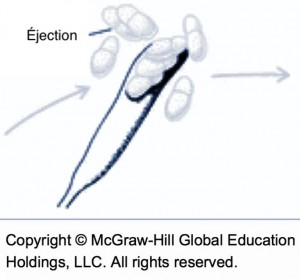
Éjection des spores (source : McGraw-Hill).
Transport des ascospores
La rupture des asques par la pression osmotique éjecte les ascospores sur une distance de quelques millimètres à l’extérieur de l’ostiole des pseudothèces. Après l’éjection, les ascospores sont portées sur plusieurs mètres par les vents et différents courants d’air souvent imperceptibles. L’action mécanique (ou l’impact) des gouttes de pluie n’a pas d’effet sur l’éjection ou la distance parcourue par les spores. La longueur du gazon n’a pas non plus d’effet sur l’éjection et n’intercepte qu’une infime fraction des spores éjectées8. La distance que peut parcourir une spore est très difficile à prévoir et est fonction de plusieurs facteurs. Elle dépend, entre autres, de l’intensité du vent et de la quantité de spores éjectées. Plus le vent est intense et plus le nombre de spores éjectées est élevé, plus la probabilité que ces spores voyagent sur de grandes distances augmente. Par exemple, en aval d’un verger abandonné, des ascospores peuvent être capturées en quantités mesurables à plus de 150 m de la source. Dans la plupart des cas cependant, la distance parcourue dépasse rarement 50 m. La propagation sur de très grandes distances est possible, mais n’a pas d’impact mesurable dans les vergers commerciaux puisque la quantité de spores produites localement est toujours beaucoup plus importante que l’apport éventuel par des vergers à plusieurs kilomètres de distance. Les efforts déployés pour réduire l’inoculum à l’intérieur et dans les abords immédiats des vergers ne sont donc pas annulés par l’arrivée de spores extérieures et plusieurs stratégies sont proposées en ce sens (voir réduction de l’inoculum).
Déposition des ascospores
Pour provoquer la maladie, les ascospores transportées par le vent doivent entrer en contact avec des parties vertes nouvellement formées du pommier. Lors de l’impact, les ascospores adhèrent rapidement aux surfaces, qu’elles soient sèches ou mouillées, et sont très difficiles à déloger. En absence d’eau sur la surface, une forte proportion d’ascospores peut survivre plusieurs heures, voire quelques jours. La proportion des spores qui survit en fonction de la durée d’exposition à des conditions sèches n’est pas complètement connue, mais dépend probablement du niveau d’exposition au soleil et de la température. Les traitements de fongicides appliqués avant les pluies forment une couche qui vise à réduire la surface où les spores pourront survivre après déposition, mais cette protection doit être renouvelée en fonction de la croissance, qui est souvent rapide pendant cette période. Les traitements de protection constituent souvent la première ligne de défense contre la tavelure.
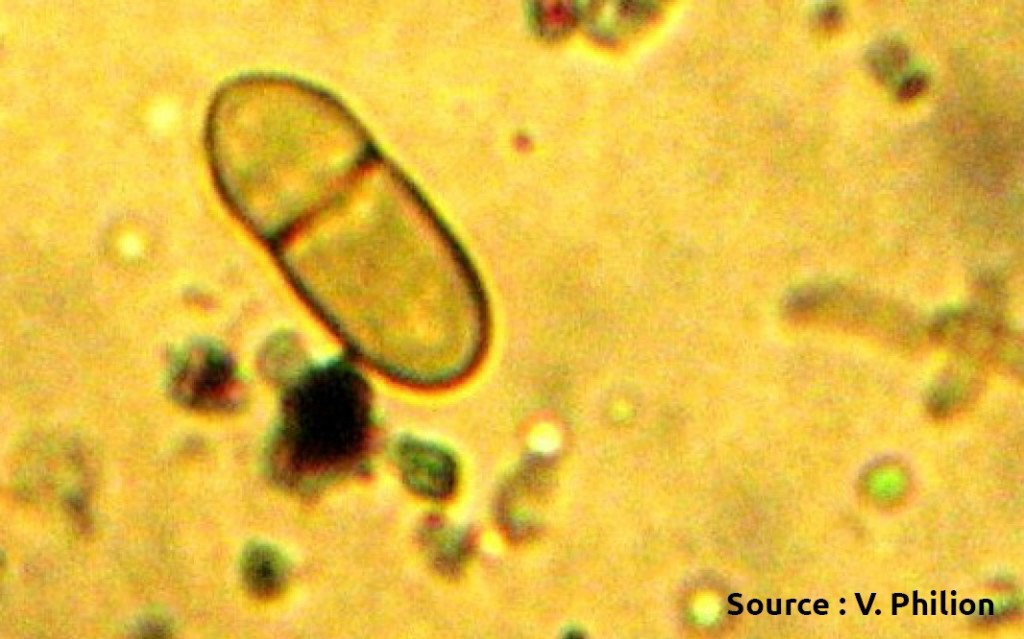
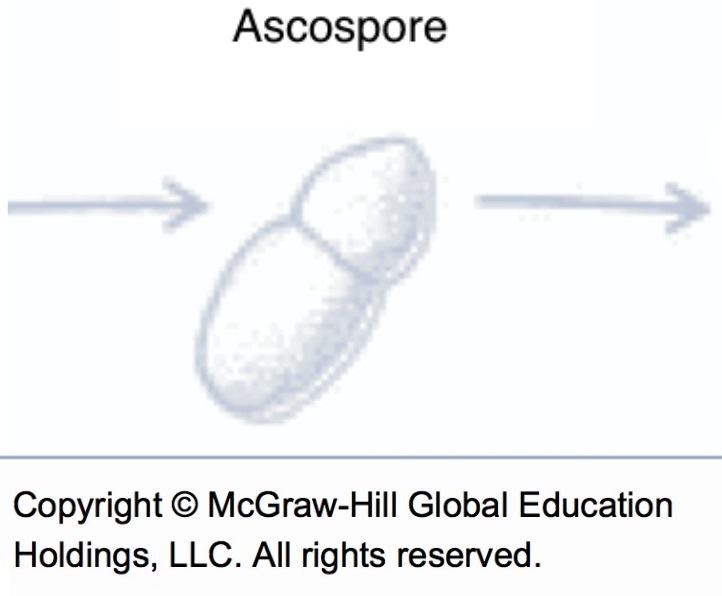
Ascospores (source : Vincent Philion et McGraw-Hill).
Germination et pénétration
En présence d’eau libre, les spores germent rapidement et forment des filaments nommés mycélium. À cette étape, le champignon peut profiter de lixiviats sucrés présents naturellement à la surface des feuilles, mais la spore ne dépend pas de la plante; elle utilise ses réserves pour permettre la croissance du mycélium en surface et, assez fréquemment, pour produire une cellule spécialisée appelée appressorium qui va faciliter la pénétration du mycélium au travers de la cuticule de la plante. Quand la surface sèche avant que la cuticule soit percée, le processus est interrompu et les spores meurent graduellement. Selon la durée du séchage, une portion des spores peut survivre jusqu’à la prochaine période d’humectation. Le cumul des périodes d’humectation interrompues par des périodes sèches peut entraîner des infections inattendues dont il faut tenir compte dans la gestion de la maladie. Les simulateurs comme RIMpro sont conçus pour comptabiliser les périodes d’humectation interrompues. La période de germination des spores est une cible privilégiée pour tuer le champignon, puisque c’est le dernier stade pendant lequel les spores sont exposées et vulnérables. La stratégie des traitements de germination est décrite dans la fiche sur La tavelure : traitements contre les infections primaires.
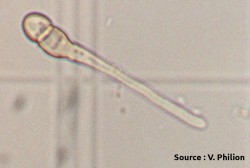
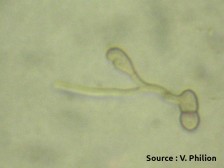
Ascospores germés et mycéliums (source : Vincent Philion).
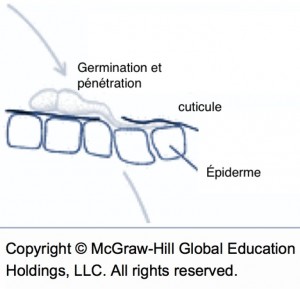 Schéma de la germination et pénétration (source : McGraw-Hill).
Schéma de la germination et pénétration (source : McGraw-Hill).
Infection
Le passage du mycélium sous la cuticule marque le moment où le champignon a infecté la plante et devient indépendant des conditions extérieures. Le champignon commence alors à dépendre des ressources de la plante. Le temps requis par la spore pour germer et ensuite passer au travers de la cuticule est la durée d’infection. La durée d’infection est variable selon l’âge de la feuille, la température, mais est aussi variable dans la population du champignon. Le temps minimum d’infection, soit le temps requis par la spore la plus rapide et dans les meilleures conditions (20 °C) sur les feuilles les plus jeunes, est d’environ 5 h9–12.
Le temps d’infection minimum augmente avec l’âge des feuilles12, au point où les feuilles les plus vieilles sont quasiment impossibles à infecter. Cette résistance naturelle liée à l’âge est dite ontogénique et n’est pas contournable par le champignon. C’est pour cette raison que les spores qui atterrissent sur des feuilles plus vieilles ne produisent que très rarement des taches.
Près du point de congélation, la durée minimale d’infection est de 32 heures à 2 °C13. La température maximale pour l’infection est de 28 °C, mais elle est complètement arrêtée si la température grimpe à 30 °C pendant plus de deux heures pendant l’infection9. Les spores déposées au même moment sur les feuilles n’infectent pas toutes en même temps, le temps d’infection est variable dans la population12. La durée de la période d’humectation est donc un facteur aggravant. Plus la période d’humectation est longue, plus la proportion des individus qui traversent la cuticule augmente et plus l’infection est sévère. La compilation des durées d’humectation requises pour provoquer une infection et leur sévérité a donné naissance à la « table de Mills », qui a été maintes fois ajustée au cours des années. La nature des interventions requises pour arrêter la tavelure change radicalement après l’infection (postinfection) puisque le mycélium est alors protégé par la cuticule cireuse de la plante et donc inatteignable par plusieurs fongicides (voir la fiche sur La tavelure : traitements contre les infections primaires).
Incubation
La période entre l’infection et l’apparition des premiers symptômes (taches) est nommée période d’incubation. Pendant cette période, le mycélium du champignon envahit discrètement l’espace sous la cuticule et prépare la production des conidies. L’incubation progresse en trois étapes.
La première étape de cette invasion consiste à former une agglomération de mycélium, nommée stroma primaire, à partir de laquelle les filaments mycéliens se multiplient et partent dans toutes les directions. La formation du stroma primaire est assez rapide et s’observe environ 24 heures après l’infection. La formation du stroma primaire est intimement liée à l’épidémiologie de la tavelure. C’est au moment de sa formation que la plante réagit à l’arrivée du champignon.
Les cultivars dotés des gènes de résistance appropriés bloquent le champignon à cette étape (voir la fiche sur La tavelure : stratégies générales de lutte), alors que la production du stroma et l’invasion subséquente sont plus ou moins freinées selon la robustesse des cultivars sensibles et l’agressivité des souches de tavelure. Quand un cultivar est prédominant dans un verger ou une région, c’est à ce stade que le mycélium le mieux adapté est favorisé. Il est possible de contrer cette spécialisation de la tavelure en favorisant la mixité des cultivars.
Finalement, les fongicides avec une efficacité restreinte en postinfection perdent graduellement leur efficacité à mesure que le stroma primaire s’établit.
La deuxième étape de l’invasion commence à mesure que les filaments mycéliens issus du stroma primaire progressent et forment à leur tour des stromas secondaires. Les premiers stromas secondaires se forment environ 72 heures après l’infection. À ce stade, seuls certains fongicides très spécialisés peuvent encore freiner la progression du champignon (voir AP et IBS). Comme le champignon est alors bien établi, les fongicides utilisés à cette étape du développement ne tuent pas le champignon mais le ralentissent jusqu’à ce que la résistance ontogénique de la feuille qui vieillit l’arrête, parfois juste avant la production de nouvelles spores. Cette survie discrète du champignon a des conséquences en matière de résistance aux fongicides et de progression de la tavelure d’automne. Ces éléments jouent contre une stratégie basée exclusivement sur des traitements de postinfection.
À la troisième étape, les stromas primaires et secondaires débutent la production des conidiophores, qui sont les sites de production des conidies.
Tout au long de l’invasion, le mycélium de la tavelure reste contraint à l’espace entre la cuticule (couche cireuse) et l’épiderme. Le champignon ne passe jamais la barrière de l’épiderme et n’entre donc jamais dans la plante tant que la feuille ou le fruit restent attachés à l’arbre. Tous les dommages causés par la tavelure sur feuillage et la tavelure sur fruits sont donc très superficiels et liés seulement à l’invasion sous-cuticulaire.
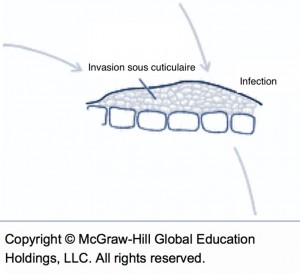
Schéma de l’invasion sous cuticulaire (source : McGraw-Hill).
Apparition des symptômes
L’apparition des symptômes de tavelure révèle de façon visible la progression du mycélium depuis le moment de l’infection. Les symptômes de tavelure deviennent visibles à l’œil nu au moment où les conidiophores percent la cuticule et que les premières conidies sont produites. Tous les organes, incluant les feuilles (limbe et pétiole), les sépales des fleurs et les fruits (incluant pédoncule), peuvent être infectés et ensuite présenter des symptômes.
Schémas des symptômes de la tavelure (source : McGraw-Hill).
Les premiers symptômes se présentent sous la forme de petites taches circulaires de couleur olive ou légèrement brunâtre. Le velouté des taches ou l’aspect « tache de cendre » très caractéristique des lésions de tavelure provient de la myriade de conidies à la surface des taches. Les lésions perdent leur aspect juvénile au cours de l’été et deviennent plus foncées.
Lésions juvéniles (gauche) et lésions avancées (droite) (source : Vincent Philion).
On observe les symptômes liés aux infections primaires principalement sur les feuilles du bouquet floral et sur les premières feuilles des pousses végétatives issues de ces bouquets, selon les feuilles jeunes exposées au moment de l’infection. Le plus souvent, les taches apparaissent sur la face supérieure des feuilles, mais des taches peuvent se manifester sur les deux faces, selon l’angle de la feuille exposée au moment de l’infection.
Quand les conditions sont favorables à la tavelure, les premiers symptômes peuvent apparaître une semaine après l’infection. Inversement, les symptômes peuvent être retardés et n’apparaître que plusieurs semaines après l’infection quand les conditions sont froides ou très sèches. De plus, comme les symptômes sont aussi retardés sur les feuilles plus âgées, la période d’apparition des symptômes issus d’une même infection peut être très étalée.
L’apparition des symptômes de tavelure à grande échelle marque un échec dans la gestion raisonnée de la maladie et entraîne une fréquence de traitements en été beaucoup plus élevée et des coûts appréciables (voir la fiche sur La tavelure : traitements d’été).
Propagation de la tavelure
Les conidies constituent la deuxième source de contamination à apparaître durant la saison. Elles causent donc des infections dites secondaires. Les infections secondaires peuvent débuter dès l’apparition des taches et se terminent à la chute des feuilles. Comme les premiers symptômes de la saison apparaissent avant que la réserve d’ascospores ne soit épuisée, les infections primaires et secondaires peuvent se chevaucher un certain temps. Mais comme les conidies sont toujours plus nombreuses que les ascospores, la gestion de la tavelure est faite en fonction des infections secondaires. Celles-ci procèdent exactement comme les infections primaires, à l’exception que les conidies ne sont pas éjectées mais simplement éclaboussées et ne sont donc pas soumises aux mécanismes d’inhibition la nuit. La germination et la pénétration des conidies, l’infection et la période d’incubation sont quasiment identiques.
Chaque nouvelle tache produit des conidies pendant deux mois environ. Par la suite, la production diminue fortement. Les conidies sont libérées sous l’effet de la pluie et sont éclaboussées sur les feuilles environnantes. Elles ne voyagent que sur une courte distance (quelques mètres), ne pouvant atteindre par conséquent que les arbres immédiatement à proximité. C’est pourquoi les foyers de tavelure sur les arbres infectés accidentellement à la suite d’une erreur de pulvérisation (bout de rangées, ouverture des buses, etc.) resteront localisés et, dans la plupart des cas, ne causeront pas de dommages à plus de 5 m du foyer initial. Les lésions secondaires se trouvent principalement au niveau des pousses végétatives, sur les feuilles en croissance au moment de l’infection. Elles sont généralement plus nombreuses sur les organes portant déjà des lésions primaires, car les conidies à l’origine de ces taches sont produites par les lésions et elles voyagent peu.
La photo suivante illustre la propagation de la tavelure sur une pousse végétative. On peut observer la présence de taches d’âges différents et des taches multiples selon l’âge des feuilles.

Tavelure sur pousse végétative (source : Vincent Philion, IRDA).
Lorsqu’elles sont très nombreuses, les lésions entraînent la chute prématurée des feuilles et des fruits. En effet, ces lésions donnent lieu à un étranglement par le champignon de la structure retenant les feuilles et les fruits à l’arbre (pétiole et pédoncule, respectivement). Plus généralement toutefois, cette chute prématurée est la conséquence d’une baisse de la photosynthèse. Les arbres très atteints peuvent être affaiblis au cours des années, mais ne sont jamais tués par la tavelure. Les arbres affaiblis poussent de moins en moins à chaque année et sont donc graduellement moins infectés.
Différents facteurs limitent la propagation de la tavelure sur le feuillage en été. D’abord, le nombre de périodes d’infection est généralement plus faible durant l’été, notamment pendant les mois de canicule. De plus, les infections n’ont habituellement lieu que sur le feuillage en pleine croissance ou sur les feuilles sénescentes, alors que les feuilles matures sont résistantes. Finalement, les taches les plus vieilles cessent graduellement de produire des conidies et cessent de contribuer à la progression de la maladie.
Tavelure sur bois
Dans les vergers très tavelés, il arrive que le bois soit infecté. La tavelure sur bois est très fréquente sur le poirier, mais les pommiers peuvent aussi en être affectés. Des conidies en lien avec les écailles des bourgeons peuvent survivre à l’hiver et deviennent une source d’inoculum primaire lors des premières infections au printemps. Cette source d’inoculum n’a jamais été rapportée au Québec, mais est parfois rapportée au sud de l’État de New York14. Dans les pays où la survie des conidies est fréquente, leur impact est généralement mineur. Dans les vergers commerciaux, on reconnaît les infections primaires liées aux conidies par l’abondance de taches sur quelques fruits en formation alors que le reste du verger est exempt de symptômes.
Tavelure sur fruits
Les lésions apparaissant sur les fruits font parfois suite à une infection primaire très grave (ex. : RIM > 1000) à partir du stade du bouton rose, mais la plupart des taches sur les pommes sont issues d’infections secondaires et sont causées par des conidies produites par des taches déjà établies sur le feuillage. La propagation de la tavelure sur fruits est donc surtout tributaire de la tavelure déjà présente sur le feuillage et par la suite de la météo en été. Quelques taches à peine décelables sur feuilles et réparties sur chaque arbre peuvent se multiplier et infecter les fruits quand les conditions sont propices à la tavelure. Plus la tavelure au point de départ de l’été est importante, plus le risque de tavelure sur fruits augmente. Ce risque doit être géré avant les infections puisqu’il n’existe pas de traitement pour éradiquer les symptômes de tavelure sur fruits.
Lorsque les infections sur fruits ont lieu tôt en saison, les symptômes entraînent une déformation telle que montrée sur la photo suivante. Un nombre élevé de taches est habituellement un signe que des conidies sont responsables des infections.

Symptômes de tavelure sur fruit (source : Vincent Philion, IRDA).
Les infections sur fruits tôt en saison entraînent une baisse de calibre ou même la chute prématurée des fruits. L’apparition des taches sur fruits s’opère comme sur les feuilles et débute par des lésions souvent d’allure juvénile, telles qu’illustrées sur les photos suivantes.
Lésions juvéniles sur fruit (source : Vincent Philion, IRDA).
Comme pour les feuilles, la résistance des fruits augmente au cours de la saison mais cette résistance est transitoire et n’est pas étanche. Quand les conditions sont propices, les infections sur fruits peuvent survenir sur des fruits de n’importe quel calibre. L’apparition des symptômes est parfois retardée sur les fruits plus résistants et est accélérée en fin de saison. On peut voir sur la photo suivante des taches âgées sur fruits matures, mais une absence de déformation.

Taches âgées sur fruit (source : Vincent Philion, IRDA).
Les infections sur fruits sont favorisées en fin de saison, au moment où les températures plus fraîches et les précipitations plus abondantes favorisent une recrudescence de la tavelure et que la résistance des fruits baisse à nouveau. La tavelure dite d’automne (pin-point en anglais) désigne justement le type de lésion qui se développe sur les fruits peu avant ou au moment de la récolte. Sur ces pommes, les taches secondaires sont souvent très petites (1 mm) et ne sont pas toujours visibles à la cueillette mais elles peuvent se développer plus tard en entrepôt. Les fruits atteints sont alors systématiquement déclassés. La tavelure n’est pas transmissible en entrepôt. Toutes les taches observées après entreposage sont issues des infections qui ont eu lieu au champ. L’entreposage en atmosphère contrôlée (AC) retarde la sortie des taches, mais ne les inhibe pas. Dans les lots de fruits infectés juste avant récolte, on observe souvent une sortie des symptômes au moment de la sortie des chambres AC, alors que les fruits étaient exempts de taches durant l’entreposage. Il est parfois possible de gérer le risque en fonction de la durée d’entreposage.
Tavelure d’automne
Les symptômes qui apparaissent à la fin de l’été et à l’automne sont souvent moins typiques et diffèrent des symptômes printaniers. À cette période, la résistance liée à la maturité des feuilles (ontogénique) cesse graduellement d’opérer et on observe une recrudescence de nouvelles infections, notamment sur les feuilles plus vieilles et sur la face inférieure des feuilles. De plus, le mycélium arrêté au printemps par la résistance ontogénique reprend sa progression et des taches apparaissent sans lien apparent avec un épisode de pluie.

Nouvelle infection en automne (source : Vincent Philion, IRDA).
Les lésions se développant à l’automne peuvent être très diffuses et rougeâtres et se rencontrent souvent le long des nervures. Il est parfois difficile de les identifier puisque la coloration des feuilles change et les taches peuvent être confondues avec des dommages d’autres ravageurs, comme la mineuse. L’évaluation de la tavelure à l’automne, dans le but de prédire les risques pour l’année suivante, est donc compliquée à la fois par l’apparition de nouveaux symptômes et la difficulté de les observer. La propagation de la tavelure cesse entièrement au moment où la feuille meurt.
Mortalité et chute des feuilles
La physiologie du champignon change au moment où la feuille meurt alors que les mécanismes de défense de la plante cessent de fonctionner. À ce moment, le mycélium peut franchir la barrière de l’épiderme et envahir toute l’épaisseur de la feuille. L’invasion translaminaire commence d’habitude une fois que les feuilles sont tombées au sol, puisque les feuilles mortes accrochées dans l’arbre ne sont pas assez humides pour favoriser la croissance du champignon. C’est à ce moment que le champignon débute sa reproduction sexuée pour pouvoir survivre à l’hiver. Selon le moment de la chute des feuilles, il est possible d’interférer avec la survie hivernale du champignon (voir méthodes de réduction de l’inoculum).
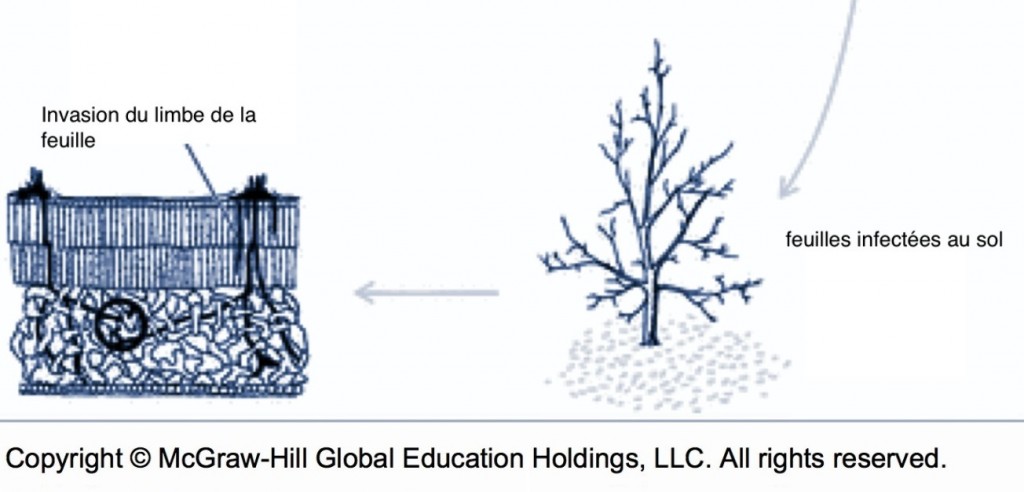
Schéma de l’invasion translaminaire (source : McGraw-Hill).
Références
- González-Domínguez, E., Armengol, J. & Rossi, V. Biology and epidemiology of Venturiaspecies affecting fruit crops: a review. Front. Plant Sci. 8. (2017)
- Samuels, G.J. & Sivanesan, A. Venturia asperata nov. and its Fusicladiumstate on apple leaves. N. Z. J. Botany. 13: 645-652. (1975).
- Caffier, V., Le Cam, B., Expert, P., Tellier, M., Devaux, M., Giraud & Chevalier, M. A new scab-like disease on apple caused by the formerly saprotrophic fungus Venturia asperata. Plant Path. 61: 915-924. (2012).
- Cruz, M. Producción de pseudotecios y ascos de Venturia inaequalis(cooke) en tres cultivares de manzano. Agri. Téc. 59: 196-204. (1999).
- Meszka, B. Study of Venturia inaequalispseudothecia development and apple scab severity under Polish conditions. Folia Hort. 27: 107-114. (2015).
- Jeger, M.J., Swait, A.J. & Butt, D.J. Overwintering of Venturia inaequalis, the causal agent of apple scab, on different cultivars. Appl. Biol. 100: 91-98. (1982).
- Stensvand, A., Gadoury, D.M., Amundsen, T., Semb, L. & Seem, R.C. Ascospore release and infection of apple leaves by conidia and ascospores of Venturia inaequalisat low temperatures. 87: 1046-1053. (1997).
- Aylor, D.E. The aerobiology of apple scab. Plant Dis. 82: 838-849. (1998).
- Sys, S. & Soenen, A. Investigations on the infection criteria of scab (Venturia inaequalis Wint.) on apples with respect to the table of Mills and Laplante. Agricultura, 18: 3-8. (1970).
- Moore, M.H. Glasshouse experiments on apple scab I. Foliage infection in relation to wet and dry periods. Appl. Biol. 53: 423-435. (1964).
- Schwabe, W.F.S. Wetting and temperature requirements for apple leaf infection by Venturia inaequalisin South Africa. 12: 69-80. (1980).
- Philion, V., Joubert, V., Trapman, M., Hjelkrem, A.-G.R. & Stensvand, A. Distribution of the Infection Time of Ascospores of Venturia inaequalis.Plant Dis. 104: 465-473. (2020).
- Stensvand, A. & Amundsen, T. Investigations on the potential ascospore dose of Venturia inaequalisin Norwegian apple orchards. IOBC-WPRS Bull. 20(9): 209-16. (1997).
- Rosenberger, D. Apple scab and quince rust now showing in Hudson valley. fruits J. 25. (2016).
Cette fiche est une mise à jour de la fiche originale du Guide de référence en production fruitière intégrée à l’intention des producteurs de pommes du Québec 2015. © Institut de recherche et de développement en agroenvironnement. Reproduction interdite sans autorisation.